Введение. В ежедневной ортопедической практике в структуре повреждений позвоночника до 75% превалирует травма грудного и поясничного отделов позвоночника [6].
Согласно данным отчета, представленным Европейской ассоциацией парентерального и энтерального питания отмечено, что от 30% до 69% пациентов общехирургического профиля поступают в клинику на фоне белково-энергетической недостаточности (БЭН) I–III степени. Эта категория больных нуждается в проведении нутритивной поддержки (НП) тем методом, который определяется конкретной клинической ситуацией [17,18]. С точки зрения доказательной медицины, раннее выявление недостаточности питания - один из ключевых моментов в лечении пациента [4,8]. Известно, что у больных с неосложненной травмой позвоночника и в большей степени с позвоночно-спинномозговой травмой, нутритивная недостаточность развивается в результате вынужденного постельного режима, снижения аппетита, синдрома кишечной недостаточности (СКН), тяжелого стресса в ответ на многоэтапное, продолжительное и высокотравматическое хирургическое вмешательство [2,3]. Известно также, что хирургическая операция вызывает катаболическое воздействие, способное ухудшить имеющийся статус питания. Особенностью синдрома гиперметаболизма после хирургической операции является несоответствие между получаемой и требуемой энергией: происходит резкое увеличение энергетических потребностей и выраженный распад белков организма до аминокислот, снижение скорости окисления глюкозы с одновременным повышением окисления липидов. Недостаточность нутриентов ведет к освобождению собственных резервов за счет деструкции тканей организма, усугублению течения основного заболевания и ухудшению его прогноза [1,5,7]. При этом имеется прямая зависимость между выраженностью питательных расстройств и ожидаемой продолжительностью лечения больных в стационаре [11-13,16], а период госпитализации может увеличиться на 30%, что нежелательно как с лечебной, так и с экономической точки зрения [17].
В этой связи при хирургическом лечении пациентов с травмой позвоночника НП должна являться важнейшим компонентом обеспечения полноценного периоперационного периода. При этом перед врачом анестезиологом-реаниматологом встает проблема оценки и коррекции нутритивного статуса на этапах хирургического лечения, которая остается объектом прицельного внимания и не имеет тенденции к снижению своей актуальности.
Цель исследования: выявить особенности нутритивного статуса у пациентов с травмой грудопоясничного отдела позвоночника на этапах хирургического лечения.
Материалы и методы. Проведено ретроспективное исследование результатов хирургического лечения 64 больных с посттравматическими деформациями позвоночника, оперированных в плановом порядке на базе травматолого-ортопедического отделения Новосибирского научно-исследовательского института травматологии и ортопедии за период 2011-2012 г. Выделено две группы наблюдений: I группа – 43 больных с неосложненной травмой грудного и поясничного отделов позвоночника; II группа - 21 больной с осложненной травмой грудного и поясничного отделов позвоночника. В обеих группах были применены современные технологии многоэтапного хирургического лечения с вмешательством на вентральных и дорсальных отделах позвоночника, в объеме однократно выполняемой операции. Во II группе этап вентрального спондилодеза проводился с декомпрессией спинного мозга. Средний возраст больных в группах составил: 36,7±7,4 лет (I), 38±11,85 лет (II). Масса тела: 75,7±4,5 кг (I), 69,1±4,3 кг (II).
Все пациенты обследованы по общепринятой в клинике схеме. Дополнительно оценивали состояние нутритивного статуса с использованием субъективной глобальной оценки по A.S. Detsky, которая была разработана как клиническая нутриционная оценка больных перед оперативными вмешательствами. В соответствии с данной шкалой 71,4% пациентов II группы имели умеренную недостаточностью питания, тогда как в I группе таких пациентов было 11,6%.
Для определения степени выраженности нутритивной недостаточности использовали антропометрические (индекс массы тела (ИМТ)) и клинико-биохимическое показатели (общий белок, альбумин, мочевина сыворотки, количество лейкоцитов, абсолютное число лимфоцитов (АЧЛ)).
Хирургические операции у пациентов обеих групп выполнялись в условиях общей анестезии с низкопоточной искусственной вентиляцией легких (1л/мин). В качестве основного анестетика использовали севофлуран на фоне введения фентанила и миоплегии эсмероном. Продолжительность хирургического вмешательства составила: 332±29,9 мин (I), 357±35,1 мин (II) (p<0,05). Объем интраоперационной кровопотери соответствовал 395,4±71,4 мл (7,7±1,3 % объема циркулирующей крови (ОЦК)) в I группе, 1128,3±707,1мл (25,2±15,7 % ОЦК) во II группе (p<0,05).
Объем и компоненты инфузионно-трансфузионного обеспечения определялись на основе количественного учета кровопотери, физиологических потребностей в жидкости, состоянием параметров гемодинамики, показателей эритроцитов, гемоглобина, гематокрита, почасового диуреза.
Этапы исследования: 1 - до операции; 2 - первые сутки после операции; 3 - пятые сутки после операции.
Статистическую обработку полученных данных проводили непараметрическими методами с использованием программы SPSS Statistic версии 20.0 с учетом небольшого количества наблюдений в группах с вычислением значений средних арифметических величин (М) и стандартных отклонений (m). Для сравнения всех временных интервалов наблюдений внутри группы использовали критерий Краскела-Уоллеса. Различия считались достоверными при p<0,05.
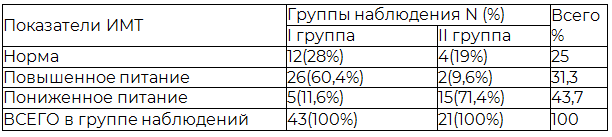
Результаты и их обсуждение. При первичном осмотре пациентов обязательным было определение ИМТ. По результатам вычислений ИМТ составил 24,3±2,01 кг/м2 в I группе и 22,1±2,2 кг/м2 во II группе. В обеих группах недостаточность питания различной степени наблюдалась у 31,3% пациентов, повышенное питание отмечено у 43,7%, нормальная масса тела у 25% (табл. 1).
Таблица 1. Показатели ИМТ в группах наблюдений
В первые сутки после операции лабораторные показатели в обеих группах характеризовались однонаправленным и достоверным снижением в сравнении с исходными значениями. Общий белок в I группе - снижение на 14,5%, альбумин - снижение на 19,4%, общий белок во II группе - снижение на 25,4 %, альбумин - снижение на 25,6% (p<0,051). Зарегистрированное статистически значимое падение показателей висцерального пула белка у больных II группы безусловно было связано с большим объемом хирургического вмешательства и значительной кровопотерей. В дальнейшем (на пятые сутки) происходило постепенное нарастание уровня общего белка крови в обеих группах, значения которого, однако были ниже исходных на 11,6% в I группе, на 19,2% во II группе. Показатели альбумина также достоверно различались и оставались ниже исходных данных на 15,9% в I группе, 20,5% во II группе (табл. 2).
У 100% больных в обеих группах на пятые сутки после операции на фоне пониженной концентрации общего белка отмечалось снижение уровня мочевины в крови (табл.2), что свидетельствовало о переходе от катаболизма к анаболизму и активном расходовании белка в результате включения компенсаторных механизмов, направленных на устранение негативных последствий операционного стресса и восстановление гомеостаза [5].
Известно, что нутритивная недостаточность ослабляет иммунную систему и оказывает побочные действия в той или иной степени на все иммунокомпетентные клетки. Считается, что самым простым тестом, косвенно отражающим выраженность супрессии иммунной системы у больных, является измерение АЧЛ. При анализе динамики АЧЛ в группах наблюдений до операции данный показатель находился в переделах нормы. После осуществления хирургического вмешательства на первые сутки отмечалось снижение показателей АЧЛ у больных в обеих группах на 19 % и 28 % соответственно (p<0,051). Зарегистрированное снижение показателей можно объяснить катаболическими процессами после выполнения высокотравматичных операций, что и привело к уменьшению абсолютного количества лимфоцитарных клеток (недостаточный висцеральный пул белка для синтеза лейкоцитов в условиях повышенной потребности в них), и снижению функции митохондриальных ферментов лейкоцитов. На пятые сутки послеоперационного периода наблюдалась некоторая тенденция к увеличению показателей АЧЛ у больных I группы, однако во II группе они оставались на более низком уровне, что отражало выраженность стресс реакции организма на операцию (табл.2).
Таблица 2. Лабораторные показателей на этапах исследования в группах наблюдений (M±m)
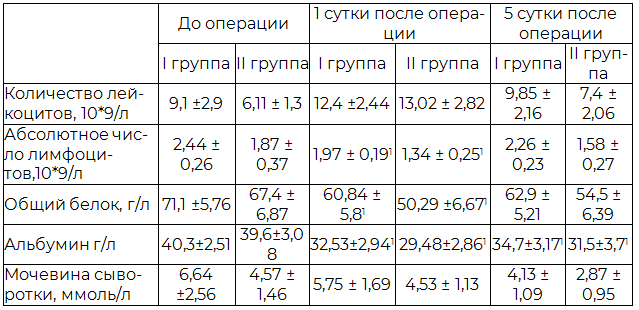
Примечание: p<0,051 – по сравнению с первым этапом (до операции).
Полученные нами данные о степени выраженности гиперметаболической реакции организма на фоне выполнения высокотравматичных операций на позвоночнике согласуются с выводами других исследователей, которые доказали, что при проведении высокотравматичных операций и имеющейся недостаточности питания резко снижается клеточный и гуморальный иммунитет, развивается вторичное иммунодефицитное состояние [5,7].
Мы полностью соглашаемся с мнением авторов, которые считают, что большую клиническую значимость имеет динамический контроль за недостаточностью питания на всех этапах хирургического лечения с оценкой как соматического, так и висцерального белковых пулов и определение направленности белкового метаболизма (азотистый баланс) [9,10,14,15,19]. При этом на современном уровне для определения суточной энергетической потребности следует использовать метод непрямой калориметрии с научно-обоснованной разработкой технологических алгоритмов нутритивной поддержки.
В обеих группах осложнений, связанных с хирургическим лечением не выявлено, однако продолжительность госпитализации в группах статистически различалась и составила: в I группе 11±3 суток, во II группе 20±4 суток.
Выводы
1. 71,4% пациентов с осложненной позвоночно-спиномозговой травмой имеют недостаточность питания умеренной степени выраженности.
2. Высокотравматичные хирургические вмешательства на позвоночнике приводят к развитию гиперметаболической реакции.
3. В хирургии позвоночника для оценки нутритивного статуса, энергопотребности и коррекции нарушений метаболизма необходимо внедрение метода непрямой калориметрии.
