Проблема выбора трансплантата для замещения передней крестообразной связки (ПКС) при её полных разрывах остаётся весьма актуальной. На сегодняшний день существуют две группы трансплантатов, которые используются для этой цели: аутоткани (фрагмент сухожилия четырёхглавой мышцы, связки надколенника, сухожилие полусухожильной мышцы и т.д.) и синтетические имплантаты (LARS-связки, ДОНА-М, лавсан и т.д.) [1,6].
Все трансплантаты обладают преимуществами и недостатками. Так, основным недостатком аутотрансплантатов является необходимость забора ткани, что ведёт к дополнительной травматизации, и необходимость более длительной и сложной реабилитации пациентов [2,4].
Использование синтетических протезов лишено вышеуказанных недостатков, однако применение этих имплантов до сих пор вызывает противоречивые мнения относительно их возможности к биоинтеграции и, как следствие, длительности «срока службы» [6].
Вопрос «выживаемости» имплантатов передней крестообразной связки при её пластике остаётся дискутабельным и весьма интересным. Имеются противоречивые мнения о том, приживаются ли полимерные волокна в коленном суставе человека, либо они так и остаются «безжизненными полимерами», которые постепенно рассасываются в организме [5,6]. Возможно, частично ответить на этот вопрос поможет случай из клинической практики, который мы наблюдали в 2013 г.
Больной Т., 26 лет, получил травму правого коленного сустава в 2011 г., в результате чего произошёл разрыв ПКС. В феврале 2012 г. больному была выполнена артроскопическая пластика ПКС синтетическим протезом фирмы «ДОНА-М» производства г. Москва. Послеоперационный период протекал без особенностей, больной вернулся к своей обычной жизнедеятельности.
Однако в 2013 г. через 16 месяцев после операции он получил повторную травму (был сбит автомобилем), в результате чего удар бампера пришёлся в область правого коленного сустава.
После данной травмы лечился консервативно, но стал отмечать нестабильность коленного сустава, по поводу чего и обратился в наше лечебное учреждение. При осмотре у больного отмечался положительный симптом «переднего выдвижного ящика», атрофии мышц бедра и голени не наблюдалось.
На рентгенограммах в стандартных проекциях (рис. 1) миграции интерферентных винтов не отмечалось (к сожалению, снимки, выполненные после операции, отсутствовали).
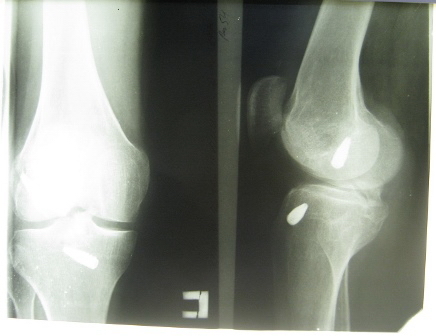
Рис. 1. Рентгенограммы больного Т. после повторной травмы правого коленного сустава.
Для оценки состояния имплантата и с целью диагностики возможного дополнительного повреждения других внутрисуставных структур была выполнена магнитно-резонансная томограмма (МРТ) коленного сустава. На МРТ было обнаружено «провисание» имплантата, который уже не выполнял свою изначальную функцию, что и привело к рецидиву нестабильности коленного сустава (рис. 2).
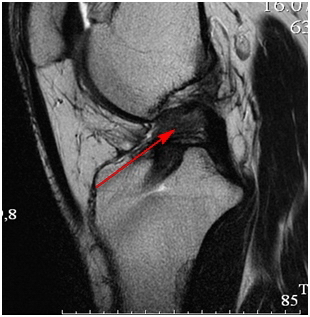
Рис. 2. МРТ коленного сустава. Видно, что имплантат (показан стрелкой) имеет «размытые» контуры, отсутствует его «натяжение».
Скорее всего, в результате повторной травмы произошло «проскальзывание» имплантата между фиксатором (интерферентным винтом) и стенкой костного канала в котором он проходил.
Было принято решение, о выполнении повторного оперативного вмешательства. План операции заключался в артроскопическом удалении предыдущего имплантата и замене его на новый.
Однако во время артроскопии было обнаружено, что имплантат представлял собой значительный конгломерат из полимерного волокна и новообразованной соединительной ткани, что создавало технические сложности для его удаления, поэтому пришлось выполнить артротомию коленного сустава (рис. 3).
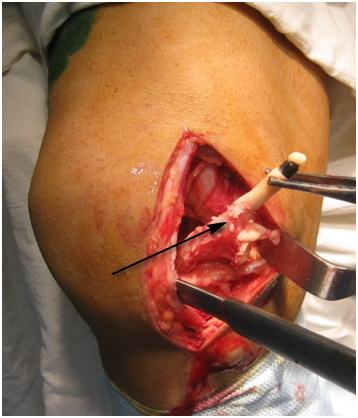
Рис. 3. Удаление имплантата из коленного сустава.
После удаления имплантата, он был направлен на гистологическое исследование (рис.4), произведена его замена на аналогичный в те же костные каналы и фиксация интерферентными винтами большего диаметра.
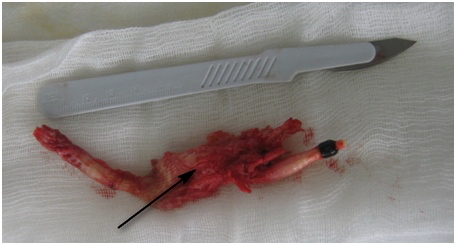
Рис. 4. Внешний вид удалённого имплантата.
Послеоперационный период протекал без особенностей. Нестабильности коленного сустава не наблюдалось.
Результаты гистологического исследования показали, что биодеградации синтетических волокон имплантата не наблюдалось (рис. 5). Между волокнами произошло массивное прорастание соединительной ткани, которая содержала бластные клетки.
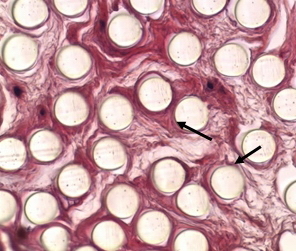
Рис. 5. Срез удалённого имплантата ПКС. Окраска гематоксилин-эозин, увеличение ×100. Стрелками показаны волокна имплантата в поперечном срезе.
Полученные результаты позволяют говорить о том, произошла биоинтеграция имплантата. Возможно, это связано с тем, что поперечные размеры его волокна сравнимы с размерами клеток (около 100 – 150 мкм) и не являются препятствием для их прорастания.
