Актуальность. Ведущими факторами в патогенезе замедленной консолидации являются ухудшение кровоснабжения и выраженные гемоциркуляторные нарушения в повреждённом сегменте (Решетников А.Н. и соавт., 2009). Сложность проблемы заключается в разнообразии патологических состояний, в ограниченном количестве методов лечения способных в короткие сроки полноценно восстановить повреждённую кость. А главное, в недостаточной потенции естественной репаративной регенерации (Виноградова Т.П., Лаврищева Г.И., 1974; Склянчук Е.Д. и соавт., 2009; Барабаш А.П., Барабаш Ю.А., Норкин И.А., 2010).
Улучшить условия для репаративной регенерации костной ткани, которая является сложным многостадийным процессом, можно путём местного воздействия в область перелома кости путем применения стимуляторов. К которым относится группа факторов роста, постоянно присутствующих в костной ткани и участвующих в физиологической и репаративной регенерации (Морозов В.П. и соавт., 2008; Барабаш А.П. и соавт., 2010). Повышенное их содержание в костной ткани позволяет с успехом использовать её в качестве стимулятора репаративной регенерации кости (Малахов O.A. и соавт., 2003; Самодай В.Г., 2008; Барабаш A.A., Барабаш А.П., Барабаш Ю.А., 2010).
Такой пристальный интерес к факторам роста и аутоплазме, служащей источником для их получения, прежде всего, обусловлен тем, что в тромбоцитах содержатся многочисленные факторы роста и цитокины, способствующие регенерации поврежденных тканей. В альфа-гранулах тромбоцитов выявлено свыше 30 ростовых факторов, которые способны влиять на процессы восстановления всех тканей сустава одновременно: кости, хряща, связочного аппарата и мышц. Из них наиболее важное значение имеют: тромбоцитарный фактор роста (PDGF) — стимулирует хемотаксис, митогенез фибробластов и синтез коллагена; фактор роста эндотелия сосудов (PDEGF) — оказывает стимулирующее действие на эндотелиальные клетки; трансформирующий фактор роста (TGF-ß). Последний представляет собой большую группу белков. Некоторые из них, так же как и морфогенные белки, модулируют клеточную пролиферацию, дифференцировку малодифференцированных клеток в остеобласты, увеличивают синтез внеклеточного матрикса кости и ингибируют его деградацию.
Материалы и методы. Работа выполнена в лаборатории научно-исследовательского института экспериментальной биологии и медицины (НИИ ЭБМ) ВГМА им. Н.Н. Бурденко в 2013 – 2014 г. В исследование включены 32 особи кроликов 4-6 месячного возраста.
В рамках проведённой экспериментальной работы было выполнено оперативное вмешательство у 5 групп кроликов. В 4-х группах (экспериментальная серия) оперативное вмешательство проводили с использованием пластины, аккумулирующей комплекс аутогенных лиофилизированых тромбоцитарных факторов роста (КАЛТФР): 1 группа – оценка остеогенеза на 7 сутки (4 кролика); 2 группа - на 14 сутки (4 кролика); 3 группа – на 21 сутки (4 кролика); 4 группа – на 28 сутки (4 кролика); 5 группа - контрольная (16 кроликов), содержащая подгруппы по 4 животных (соответственно по аналогичным срокам опытных групп). Техника накостного остеосинтеза идентичная для всех, за исключением отсутствия у контрольной группы КАЛТФР помещаемого в зоне перелома.
Техника моделирования перелома бедра: под в/м наркозом раствором Золетила, после обработки операционного поля спиртовым раствором хлоргексидина трехкратно по переднемедиальной поверхности бедра животным производили разрез кожи длиной около 5 см. Мышцы разводили и фиксировали ранорасширителями. В области средней трети диафиза бедра выполняли остеотомию фрезой диаметром 1 мм. На поврежденную кость после репозиции укладывали модифицированную реконструктивную пластину, которую фиксировали 4-6 винтами. Модификация пластины заключалась в формировании на прилегающей к кости поверхности небольших углублений диаметром 0,5-1 мм и глубиной 0,3-0,5 мм для механического депонирования комплекса аутогенных лиофилизированых тромбоцитарных факторов роста. Рану послойно ушивали кетгутом, и закрывали асептической лейкопластырной повязкой «Круподерм» со спиртовой салфеткой. Послеоперационный период протекал гладко. Испытуемые в тот же день начинали есть. Инфекционных осложнений отмечено не было, все раны заживали первичным натяжением. Но, к сожалению, из-за активизации животных в условиях отсутствия иммобилизации произошло 2 случая миграции металлоконструкции (6,25%). После истечения обозначенных сроков выполняли гистологическое исследование.
Выведение животных из эксперимента и забор материала осуществлялся на 7-е, 14-е, 21-е, 28-е сутки наблюдения. На аутопсии оценивали состояние окружающих мягких тканей, состояние надкостницы, кортикального слоя и костномозгового канала. Забор материала для гистологического исследования проводили путем тщательного сепарирования мышц от костей, выделения сегментов костей длиной 2,5-3 см с областью костного регенерата. Костный материал фиксировали в 10% забуференном растворе цинк-формалина в течение трех суток, подвергали декальцинации в растворе «Трилон-В» в течение 3 недель, обезвоживали в спиртах возрастающей концентрации и заливали в парафин. Срезы толщиной 4,0 мкм окрашивали гематоксилин-эозином, методом полного антиоксидантого статуса (ПАС, Total Antioxidant Status, TAS),по Массону с анилиновым синим, альциановым синим pH 2.5. Микроскопическое исследование проводили на светооптическоммикроскопе (Leica MDE, Германия) с применением увеличения х5, х10, х20.
Результаты и обсуждение. При сравнительном рассмотрении микроскопических препаратов экспериментальной 1 группы исследуемых животных на 7 сутки отмечается большее число клеток гиалинового хряща и остеобластов. Помимо этого присутствуют признаки небольшого межтканевого пространства, что указывает на более компактную структуру образующихся тканей и слабую воспалительную реакцию (рис. 1).
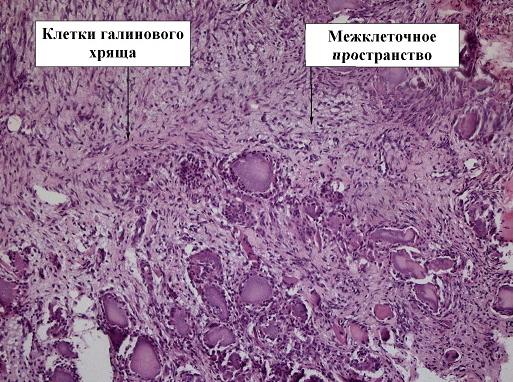
Рис. 1. Препарат костной мозоли перелома бедра кролика, 1 экспериментальная группа, срок 7 дней, окраска гематоксилин-эозином, ув. х10
В препарате животных контрольной группы сохраняются признаки воспалительного процесса, препятствующие формированию рубцовых тканей. В таких условиях увеличивается продолжительность сроков консолидации, что свидетельствует о замедлении процесса репаративного остеогенеза (рис. 2).
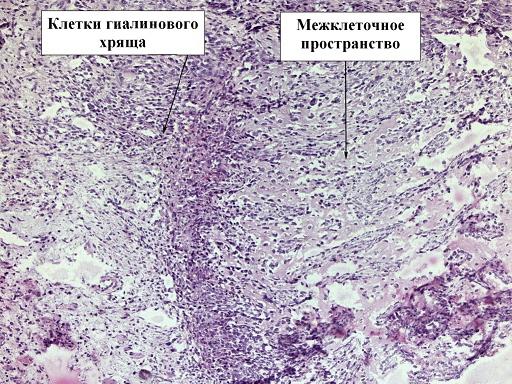
Рис. 2. Препарат костной мозоли перелома бедра кролика, 5 контрольная группа, срок 7 дней, окраска гематоксилин-эозином, ув. х10
К 14 дню происходит завершение образование хрящевой ткани и начинается процесс её оссификацией и появляется грубоволокнистая или, другими словами, губчатая костная ткань - формируется первичная косная мозоль. Это отчетливо прослеживаются как в контрольной, так и экспериментальной группах (рис. 3, 4).
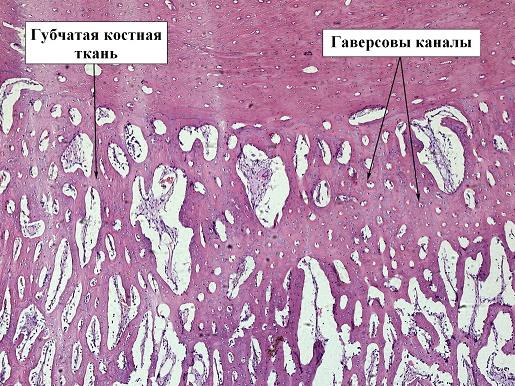
Рис. 3. Препарат костной мозоли перелома бедра кролика, 2 экспериментальная группа, срок 14 дней, окраска гематоксилин-эозином, ув. х10
При этом у 2 экспериментальной группы костная ткань более компактная, местами даже прослеживается появление гаверсовых каналов, что является признаком перехода губчатой кости в плотную.
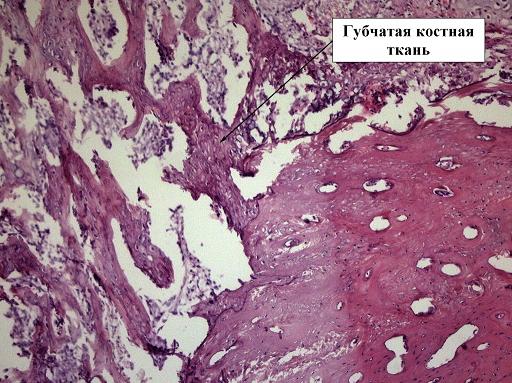
Рис. 4. Препарат костной мозоли перелома бедра кролика, 5 контрольная группа, срок 14 дней, окраска гематоксилин-эозином, ув. х10
На микроскопических препаратах, выполненных на 21 день, ключевым является остаточное количество хрящевой ткани и наличие признаков восстановления микроциркуляции. В срезе препаратов экспериментальной группы животных мы четко видим наличие множества микроскопических сосудов, обеспечивающих адекватную трофику тканей (рис. 5). Именно поэтому клетки хондроцитов плотно расположены друг к другу, замещаясь остеоцитами, которые активно накапливают кальций.
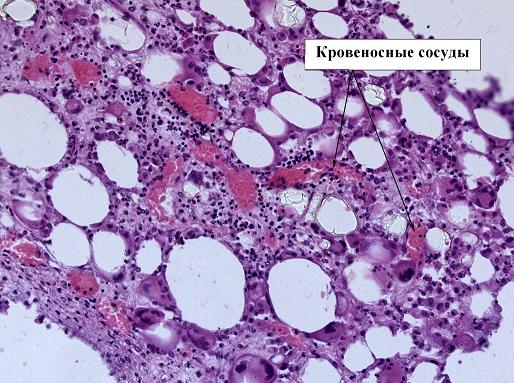
Рис. 5. Препарат костной мозоли перелома бедра кролика, 3 экспериментальная группа, срок 21 день, окраска гематоксилин-эозином, ув. х20
В препарате контрольной группы на тех же сроках, мы видим плохо организованные редкие капилляры, что на наш взгляд вызывает угнетение остеогенеза и приводит к развитию полноценной хрящевой ткани, замедляя её трансформацию в костную ткань. Об этом свидетельствует наличие хондроцитов крупного размера (рис. 6).
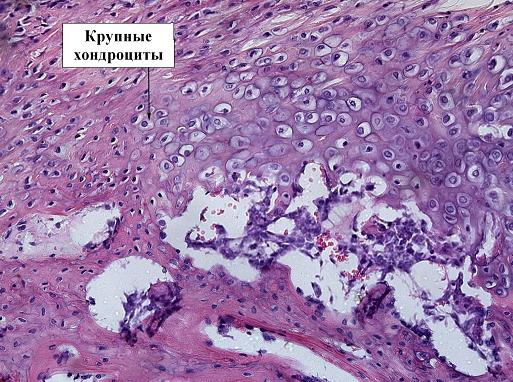
Рис. 6. Препарат костной мозоли перелома бедра кролика, 5 контрольная группа, срок 21 день, окраска гематоксилин-эозином, ув. х20
У 5 контрольной группы на 28 день отмечается активный процесс оссификации молодой кости (рис. 7). Сохраняется большое количество хондроцитов и остеобластов. Это означает, что для сращения необходимо еще какое-то время.
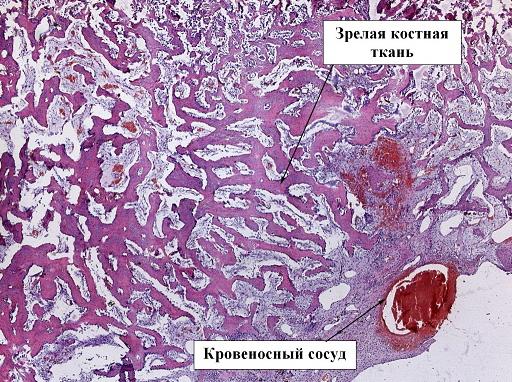
Рис. 7. Препарат костной мозоли перелома бедра кролика, 5 контрольная группа, срок 28 дней, окраска гематоксилин-эозином, ув. х5
На препарате зоны перелома 4 экспериментальной группы животных мы видим уже сформированную кость, богатую кровеносными сосудами, достаточно большого калибра (рис. 8).
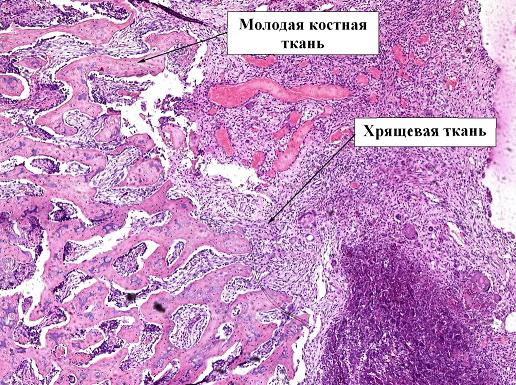
Рис. 8. Препарат костной мозоли перелома бедра кролика, 4 экспериментальная группа, срок 28 дней, окраска гематоксилин-эозином, ув. х2,5
Выводы. Изложенные выше материалы гистологического метода исследования указывают на значительное ускорение консолидации переломов, что послужило активирующим механизмом раннего остеогенеза, тем самым снижая сроки сращения переломов. Можно также подчеркнуть, что благодаря модифицированной структуре пластин достигнуто направленное действий КАЛТФР, при этом сохраняется высокая концентрация факторов роста, что стимулирует остеоиндукцию в требуемом для нас участке кости. Опираясь на результаты гистохимического исследования тканей области перелома, установлено ускорение роста и деления клеток хондроцитов и остеобластов.
Таким образом, наше экспериментальное исследование по результатам гистологического исследования позволяет констатировать, что использование аутогенных тромбоцитарных факторов роста может ускорить сроки восстановление больных с переломами.
