В конце 20-го века при хронической передней нестабильности коленного сустава самой популярной методикой была артроскопическая транстибиальная пластика передней крестообразной связки (ПКС) с акцентом на изометрическое расположение трансплантата. Формирование бедренного туннеля производилось через большеберцовый, что обуславливало расположение бедренного туннеля в зависимости от расположения большеберцового. Данная методика позволяла получать отличные и хорошие результаты в ближайшем и среднесрочном послеоперационном периодах до 80-90% [3, 7, 20]. Однако в отдаленном послеоперационном периоде в оперированном коленном суставе часто развивались дегенеративные изменения. Среди вероятных причин возникновения и прогрессирования остеоартроза называли сохраняющиеся после традиционной (транстибиальной) реконструкции ПКС элементы нарушенной кинематики коленного сустава и остаточную нестабильность вследствие слабого контроля «новой связкой» ротации большеберцовой кости [4, 11, 15, 21]. В 21-м веке методики реконструкции ПКС были пересмотрены с основным упором на «анатомичную» реконструкцию, так как при этом удавалось достичь большей передне-задней и ротационной стабильности в коленном суставе [13, 14, 22]. Jonsson H. с соавт. в результате исследований пришли к мнению, что «анатомичная» реконструкция ПКС может привести к улучшению долгосрочного результата с возможным снижением риска прогрессирования остеоартрозав оперированном коленном суставе [10]. Философия «анатомичной» однопучковой реконструкции ПКС предполагает расположение трансплантата относительно центров нативного прикрепления связки на мыщелках бедренной и большеберцовой костей. Это стало возможным с внедрением методик формирования бедренного туннеля вне зависимости от положения большеберцового туннеля [12, 13, 14, 16]. В последнее время всё большей популярностью пользуются методики реконструкции ПКС с «анатомичным» расположением трансплантата, что обусловлено лучшими биомеханическими характеристикамипо сравнению с изометрическим расположением [9, 12, 13, 16-18]. Кроме того, формирование бедренного туннеля в более горизонтальном положении дает возможность позиционирования большеберцового туннеля кпереди без контактного конфликта с краем межмыщелковой ямки бедренной кости и трансплантатом-«impingement» [14]. В исследованиях Franceska Zampeli и соавт. «InVivo» было показано значительное улучшение ротационной стабильности коленного сустава при более остром угле расположения трансплантата во фронтальной плоскости, а также улучшение передне-задней стабильности при более остром угле расположения трансплантата в сагитальной плоскости [5]. По мнению Лисицына М.П., одной из причин рецидива нестабильности коленного сустава являются ошибки оперативного лечения, характеризующиеся в несоблюдении изометрии трансплантата во всем диапазоне движений коленного сустава [1]. В норме нативная ПКС присгибательно-разгибательных движениях в коленном суставе в диапазоне 90° удлинняется до 3.3 мм (7-8% длины ПКС) [6, 19]. В результате исследований Jae-Sung Lee и соавт., основанных на изучении 10 трупных коленных суставов, было показано, что при «анатомичном» расположении бедренного туннеля изометрическое напряжение трансплантата ПКС меньше, если большеберцовый туннель располагался кпереди от традиционного расположения. Но по мнению самих авторов, данное исследование имело некоторые ограничения, потому что исследования проводились на трупном материале, что не может полностью соответствовать биомеханике коленного сустава «InVivo» [8].
Целью данного исследования была интраоперационная оценка изометрического напряжения трансплантата «InVivo» при «анатомичном» расположении бедренного туннеля при стандартном и переднем расположении большеберцового туннеля. Выполнение данного исследования стало возможным благодаря разработанной нами объективной методики измерения изометрического напряжения трансплантата при различных углах сгибания в коленном суставе.
Материалы и методы. В данное исследование были включены две группы пациентов по 15 человек с застарелыми повреждениями ПКС, которым в период с 2012 по 2013 г. в ГКБ №12 г. Москвы была выполнена артроскопическая реконструкция ПКС. Первую группу составили пациенты, которым была выполнена реконструкция ПКС с использованием однопучковой «анатомичной» методики с ретроградным формированием бедренного канала и традиционным расположением большеберцового канала в центре культи ПКС на уровне заднего края переднего рога латерального мениска (мужчин 11(73%), женщин 4(23%), средний возраст 26±8 лет). Вторую группу составили пациенты, которым была выполнена реконструкция ПКС с использованием однопучковой «анатомичной» методики с ретроградным формированием бедренного канала и расположением большеберцового канала кпереди от традиционного на культе ПКС в центре воображаемой линии, соединяющей задний край переднего рога медиального мениска и задний край переднего рога латерального мениска (мужчин 10(68%), женщин 5(32%), средний возраст 26±7 лет).
В первой группе пациентов повреждение ПКС правого коленного сустава составило - 11 (73%), левого - 4 (27%). Во второй группе: правого-10 (68%), левого - 5 (32%). Характеристика сочетания повреждений ПКС и менисков показано на рис. 1.
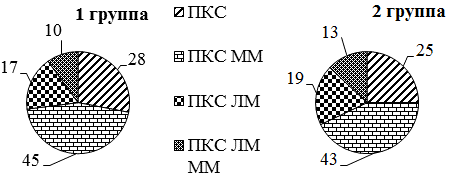
Рис. 1. Характеристика повреждений: ПКС - изолированное повреждение передней крестообразной связки; ПКС ММ - повреждение связки и медиального мениска; ПКС ЛМ - повреждение связки и латерального мениска; ПКС ЛМ ММ - повреждение связки и обоих менисков (%).
Оперативная техника. Во всех случаях использовалась спинномозговая (СМА) анестезия с нейровегетативной защитой. Положение пациента на спине. Пневматический турникет накладывался на верхнюю треть бедра. Конечность фиксировалась в держателе на уровне верхней трети бедра. После обработки растворами антисептиков операционное поле ограничивалось при помощи непромокаемого одноразового артроскопического белья. Диагностическая артроскопия выполнялась с использованием стандартных передних доступов: переднелатерального и переднемедиального. Также использовался верхненаружный доступ для установки промывной канюли. Определялись степень и тип повреждения ПКС, диагностировались сопутствующие внутрисуставные повреждения менисков, хряща и др. В своей работе в качестве пластического материала для замещения поврежденной ПКС мы использовали трансплантат из сухожильных частей полусухожильной и нежной мышц. В качестве имплантов для фиксирования трансплантата использовался биодеградируемый винт в бедре и биодеградируемый винт с гильзой в большеберцовой кости (smith&nephew BIORCI, DePuyBIO-INTRAFIX TibialSheath, Tapered Screw). При заборе трансплантата коленному суставу придавалось сгибание 90-95° и выполнялся косой кожный разрез 3-5см. Он располагался на 2,5см медиальнее бугристости большеберцовой кости по направлению к подколенной области в проекции прикрепления сухожилий «гусиной лапки». Далее вдоль волокон вскрывалась сарториальная фасция, выделялись сухожилия полусухожильной и нежной мышц. Преимуществом косого разреза являлась наименьшая вероятность повреждения подкожного нерва. Проксимальную часть фрагментов забирали сухожильным экстрактором с пересечением мышечно-сухожильной части, дистальные концы отсекали вместе с периостом. На препаровочном столике производилась обработка трансплантата, сухожилия складывались, прошивались их дистальные и проксимальные концы. Из полученного материала формировали 4-х пучковый трансплантат в среднем длиной 11 см, диаметром 8 мм. От проксимального конца трансплантата маркером или прошиванием до нужного уровня отмечалось расстояние в 30 мм. Эта метка необходима для определения глубины погружения трансплантата в бедренный костный канал. После растягивания на препаровочном столике определялась толщина созданного трансплантата ПКС.
Формирование большеберцового туннеля. Наборы механических инструментов позволяли выполнять пластику ПКС, используя метрическую и градусную шкалы. Большеберцовый направитель (Arthrex) имел форму полуокружности и был основан на эффекте перекрещивания двух радиальных осей в одной плоскости в строго определенной точке. В первой группе пациентов внутрисуставной наконечник большеберцового направителя устанавливался на центр культи ПКС на уровне заднего края переднего рога латерального мениска. На внесуставной дуге направителя заранее выставляли угол равный 55-60° по отношению к горизонтальной поверхности плато большеберцовой кости. Направляющая ножка направителя для спицы устанавливалась так, чтобы она проходила через кожный разрез, ранее используемый для забора трансплантата, и упиралась в большеберцовую кость на 1- 1,5 см кнутри от медиального края бугристости. Во второй группе пациентов внутрисуставной наконечник большеберцового направителя устанавливался на культе ПКС в центре воображаемой линии, соединяющей задний край переднего рога медиального мениска и задний край переднего рога латерального мениска, на внесуставной дуге направителя заранее выставляли угол равный 50-55° по отношению к горизонтальной поверхности плато большеберцовой кости. При этом направляющая втулка направителя для спицы устанавливалась так, чтобы она проходила через кожный разрез, ранее используемый для забора трансплантата и упираласьв большеберцовую кость на 2,5-3см кнутри от медиального края бугристости большеберцовой кости. На этом этапе под артроскопическим контролем выполнялось разгибание коленного сустава. По расположению внутрисуставного наконечника направителя оценивалось дальнейшее расположение трансплантата. «Анатомичный» горизонтальный бедренный туннель позволял располагать внутрисуставный наконечник направителя кпереди по сравнению с традиционным туннелем без риска контактного конфликта края межмыщелковой ямки бедренной кости и трансплантата- «impingement». Маркировочные деления на втулке позволяли определить длину формируемого большеберцового туннеля. По втулке проводили спицу так, чтобы ее внутрисуставной конец выходил точно в центр предполагаемого большеберцового туннеля. Далее по спице канюлированной головчатой фрезой или сверлом диаметром, равным диаметру трансплантата в медиальном мыщелке большеберцовой кости, формировали сквозной канал снаружи - внутрь.
Формирование бедренного туннеля в обеих группах производилась по одинаковой методике.
Суставу придавалось сгибание 70-90°. При необходимости в случаях остеофитов в области межмыщелковой вырезки и для лучшей визуализации латерального мыщелка бедренной кости выполнялась экономная резекция края межмыщелковой вырезки «notchplasty». Бедренный направитель (Arthrex) имел форму полуокружности и был основан на эффекте перекрещивания двух радиальных осей в одной плоскости в строго определенной точке. При формировании бедренного канала внутрисуставно ориентировались на ниже перечисленные критерии:
- остатки культи ПКС. В этом случае искомый центр находился в центре культи;
- латеральный межмыщелковый (Lateral intercondylar ridge) и бифуркационный край (Lateral bifurcate ridge). Для лучшей визуалицации данных референтных структур с помощью ручных инструментов, шейвера, радиочастотнога электрода удаляли остатки культи ПКС, снимали тонкий слой мягких тканей, покрывающий внутреннюю поверхность наружного мыщелка бедренной кости. Искомый центр смещали на 1,5мм проксимальнее и 1,5 мм кзади от точки пересечения межмыщелкового и бифуркационного края с учетом того, что область прикрепления передне-внутреннего (ПВП) пучка связки больше, чем задне-наружного (ЗНП);
- в тех случаях, когда после дебридмента не удавалось установить латеральный межмыщелковый и бифуркационный край. Использовали артроскопическую линейку. Искомый центр бедренного прикрепления ПКС находился в 43 % от проксимально- дистальной длины латеральной стенки межмыщелковой вырезки и 2,5мм+R (R-радиус трансплантата) от заднего суставного края внутренней поверхности латерального мыщелка бедра [8].
Установленный центр бедренного приклепления ПКС отмечали при помощи микрофрактора или радиочастотного электрода. На внесуставной дуге направителя заранее выставляли угол, равный 115°. Внутрисуставной наконечник направителя вводился в сустав через стандартный передне-медиальный порт и устанавливался на отметку. Наклон внесуставной части дуги направителя относительно трансэпикондилярной линии составлял 20-40°. В неё устанавливали направляющую втулку для спицы так, чтобы она проходила через предварительно сформированный кожный разрез длиной 1-1,5 см и упиралась в кость кпереди от латерального надмыщелка бедра. Маркировочные деления на втулке позволяли определить длину формируемого бедренного туннеля. По втулке проводили спицу так,чтобы ее внутрисуставной конец выходил точно в центре расположения предполагаемого бедренного туннеля. На этом этапе для лучшей визуализацииместа выхода спицы в некоторых случаях производилась временная смена артроскопического доступа с передне-латерального на передне-медиальный. Далее по спице канюлированной головчатой фрезой или сверлом диаметром равным диаметру трансплантата в латеральном мыщелке бедренной кости формировали сквозной туннель снаружи-внутрь. Когда костные туннели оказывались полностью подготовленными, под артроскопическим контролем трансплантат проводился в сустав через большеберцовый костный туннель с помощью артроскопического зажима, артроскопического крючка и длинных технологических нитей. Далее тонкая 1,1 мм спица вводилась в щель между трансплантатом и краем бедренного костного туннеля при сгибании коленного сустава от 70 до 90°. При общем натяжении трансплантата по спице вводился интерферентный винт, плотно фиксировавший трансплантат в бедренном канале. Винты использовались диаметром 7-9 мм и длиной 25-35 мм, при этом винт вводился до полного погружения головки в максимально параллельном направлении относительно оси бедренного канала. После фиксации трансплантата в бедренной кости выполнялась оценка изометрии трансплантата при одинаковом натяжении и различных углах сгибания в коленном суставе. Эти испытания позволяли оценить правильность изометрического расположения трансплантата в костных каналах. Следующий этап операции заключался в фиксировании дистального конца трансплантата в большеберцовом костном канале. Суставу придавалось сгибание 15-30°, трансплантат натягивался до напряжения 8 кг. Под артроскопическим контролем фиксировался биорассасывающимся интерферентным винтом с гильзой. До их введения щель между пучками трансплантата последовательно расширялась с помощью расширителей до соответствующего диаметра гильзы. Винты использовались диаметром 7-9мм и длиной 35мм с максимальным погружением в большеберцовый канал. На последнем этапе артроскопически осматривался созданный аутотрансплантат ПКС, оценивалось его напряжение и взаимоотношение с наружной стенкой мыщелка бедра и крышей бедренной вырезки. В исследуемых группах мы не наблюдали контактного конфликта края межмыщелковой ямки бедренной кости и трансплантата «impingement». Сустав промывался, оценивался объём движений, Лахман тест, симптом переднего выдвижного ящика (ПВЯ). В полость сустава на сутки устанавливался активный дренаж. Выполнялось послойное ушивание ран с наложением стерильных повязок. Производилась иммобилизация конечности брейсом.
Оценка изометрии трансплантата. Интраоперационно после фиксации трансплантата в бедре и до фиксации в большеберцовой кости выполнялась оценка изометрического напряжения трансплантата. При классической методике проверки изометрического напряжения трансплантата пальцы хирурга располагались у выхода большеберцового канала, а ассистент производил сгибательно-разгибательные движения в коленном суставе. При этих движениях хирург ощущал отсутствие или наличие смещения трансплантата или увеличение его напряжения. Эти испытания позволяли предположить правильность изометрического расположения трансплантата в костных каналах. Существенным недостатком данной методики по нашему мнению являлась субъективность полученных результатов. С целью повышения объективности результатов нами была разработана методика оценки изометрии трансплантата при одинаковой силе натяжения в различных углах сгибания в коленном суставе. Для этого использовался натяжитель-динамометр (Mitek), линейка, гониометр, технологические нити. Дистальные концы нитей, которыми прошивались пучки трансплантата фиксировались в натяжителе, производились сгибательно-разгибательные движения в коленном суставе для адаптации трансплантата. Трансплантат натягивался до напряжения 8 кг. На дистальную часть трансплантата накладывался поперечный узловой шов (викрил 3,0), который использовался в качестве метки. В положении полного разгибания в коленном суставе 0° линейкой измерялось расстояние от крыши большеберцового костного туннелядо метки «a», далее суставу поочередно придавалось положение сгибания 30, 60, 90 и 120°, при этом натяжение трансплантата также составляло 8кг. Линейкой измерялось расстояние от крыши большеберцового костного туннеля до метки на дистальной части трансплантата «b» (Рис. 2). От полученного значения при полном разгибании «а» вычитались значения, полученные при 30, 60, 90 и 120° сгибания «b» в коленном суставе. Результаты «с» документировались для дальнейшего анализа.
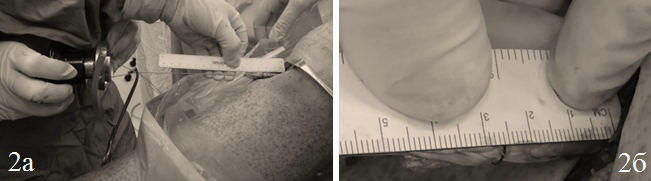
Рис. 2. Измерение изометрического напряжения трансплантата ПКС (а, б); a-b=c; a - показание на линейке при 0° сгибания, b - показание на линейке при 30, 60, 90, 120° сгибания, c - изометрическое напряжение трансплантата, (мм).
Таблица 1. Результаты среднего значения и стандартного отклонения изометрического напряжения трансплантата (мм)
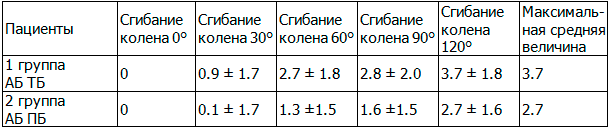
Примечания: АБ ТБ - анатомичный бедренный традиционный большеберцовый туннель, АБ ПБ - анатомичный бедренный передний большеберцовый туннель.
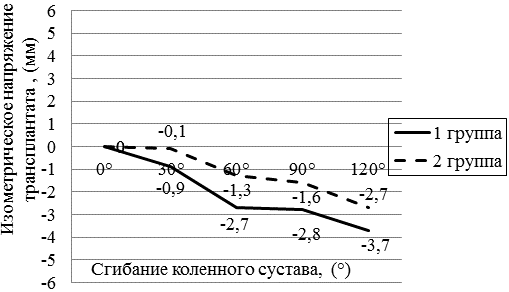
Рис. 3. Измерение изометрического напряжения трансплантата ПКС при различных углах сгибания в коленном суставе (мм).
Результаты и обсуждение. Нами были проанализированы результаты интраоперационного измерения изометрического напряжения трансплантата по разработанной методике. При помощи статистического анализа, были вычислены средние значения и стандартное отклонение. Наибольшее изометрическое напряжение трансплантата в обеих группах была при полном разгибании в коленном суставе. При угле сгибания в 30°во второй группе отмечалось меньшее изометрическое напряжение трансплантата (табл. 1, рис. 3) По нашему мнению, этот показатель может иметь клиническое значение, так как при данном угле сгибания производится фиксация трансплантата. По мнению Austin и соавт., при неизометрическом расположении трансплантата при анатомичной реконструкции ПКС и фиксации трансплантата при 30° сгибания, в последствии может развиться сгибательная контрактура в коленном суставе [2]. Также, при заданных углах сгибания, отмечалось меньшее изометрическое напряжение у пациентов второй группы, что указывало на более предпочтительное расположение большеберцового туннеля кпереди. Максимальная средняя величина изометрического напряжения трансплантата при объеме движений от 0 до 120° сгибания составляла в первой группе 3,7 мм, во второй группе 2,7 мм. В исследовании Лисицына М.П., при использовании навигации при реконструкции ПКС изометрическое напряжение трансплантата по данным программы Orthopilot, ACL, V 1.2 считалось допустимым до 4 мм [1]. Длина большеберцового туннеля в первой группе составляла 37±3,2 (от 30 мм до 42 мм). Длина большеберцового туннеля во второй группе составляла 36±2,3 (от 31 мм до 40 мм).
Заключение. При анатомичной реконструкции передней крестообразной связки предпочтительно расположение большеберцового туннеля кпереди, нежели традиционное расположение. При данном расположении определяется меньшее изометрическое напряжение трансплантата во всем диапазоне движений в коленном суставе. Так же при угле сгибания от 0° до 30° отмечалось незначительное изометрическое напряжение трансплантата. По нашему мнению, этот показатель может иметь клиническое значение, так как при данном угле сгибания производится фиксация трансплантата. При переднем расположении длина большеберцового туннеля в среднем составляла 36±2,3мм и была достаточной для плотной фиксации трансплантата. Данное расположение каналов следует изучать в дальнейшем для оценки кинематики сустава и развития дегенеративных изменений в отдаленном периоде.
