Актуальность. В современной медицине остро стоит проблема заболеваний молочной железы. Рак молочной железы давно и прочно удерживает первое место в структуре онкологических заболеваний женской репродуктивной сферы [1]. Наряду с этим отмечается высокая частота встречаемости доброкачественных изменений молочных желез, наибольшее количество из которых составляют различные формы диффузной фиброзно-кистозной мастопатии (ДФКМ). В последнее время все чаще авторы прибегают к термину гиперпластические процессы молочной железы [2], который отражает морфологическую суть изменений при различных формах диффузных мастопатий.
Своевременная диагностика и лечение таких состояний важна в силу многих причин. Основная из них, это риск развития рака молочной железы при пролиферативных формах заболевания [7,8], так же наличие выраженной клинической симптоматики и психологического дискомфорта у женщины при выявлении ДФКМ [3]. В настоящее время существует множество методов лечения ДФКМ, включающих в себя гормональную и негормональную терапию, но до сих пор нет единых критериев оценки эффективности проводимой фармакологической коррекции.
Цель исследования: определить диагностические критерии оценки эффективности лечения различных форм диффузной фиброзно-кистозной мастопатии.
Материалы и методы: с января по декабрь 2011 г. в Президентском медицинском центре г. Астана диагностическую цифровую маммографию по стандартной методике прошли 1076 женщин в возрасте от 35 до 75 лет. Для дополнительного ультразвукового исследования (УЗИ) применяли мультичастотный линейный датчик 7,5-10 мГц. УЗИ проводили по стандартной методике, модифицированной (Солнцевой И. А.) с измерением толщины железистой ткани от переднего до заднего листка расщепленной фасции в месте, где толщина железистого пласта является максимальной с целью определения наличия гиперплазии железистой ткани [5]. У менструирующих женщин УЗИ проводилось с 6 по 12 день менструального цикла.
Так же была проведена допплерография артерий паренхимы молочных желез с регистрацией основных допплерометрических показателей: максимальной (пиковой) систолической скорости кровотока (Vmax.sist), конечной диастолической скорости кровотока (Vend.sist), средней линейной скорости (TAMX), пульсационного индекса (PI), индекса резистентности (RI), систоло-диастолического (S/D) отношения, характеристики спектрограмм.
Для сосудов молочных желез характерен артериальный тип кровотока с низким периферическим сопротивлением, при этом отчетливо дифференцируются 2 основных спектральных пика – систолический и диастолический. Наиболее ценную диагностическую информацию несет значение максимальной систолической скорости, а так же значение уголнезависимого индекса резистентности (RI) и пульсационного индекса (PI). В норме артерии паренхимы молочных желез по данным Заболотской Н. В. в среднем имеют максимальную скорость Vmax.sist 10,13 см/сек [2], но могут достигать значений 16,1 см/сек. При исследовании значений индекса резистентности и пульсационного индекса в 1997-2004 г. авторы предложили нормативные значения RI<0,75 и PI<1,0 [6,9], в более поздних работах [2] значение RI составило 0,55-0,56.
В нашем исследовании за норму были приняты значения RI от 0,55 до 0,75 и PI<1,0. Исследование проводилось в симметричных участках обеих молочных желез.
Перед комплексным ренгено-ультразвуковым исследованием было проведено клиническое исследование, включающее сбор анамнеза, осмотр и пальпацию молочных желез. При наличии выделений из соска молочной железы проводилось цитологическое исследование отделяемого, так же при кистах размером более 10 мм, проводилась тонкоигольная аспирационная биопсия (ТАБ) под УЗИ-контролем с последующим цитологическим исследованием аспирата.
Для оценки эффективности лечения ДФКМ по данным комплексного обследования сформирована основная группа (1 группа) в количестве 159 женщин в возрасте от 35 до 55 лет (45±10 лет). Критериями включения в исследуемую группу были наличие диффузной фиброзно-кистозной мастопатии вне зависимости от формы и степени выраженности, отсутствие атипичных клеток при цитологическом исследовании. Критериями исключения из группы было наличие узлового образования в одной или обеих молочных железах, наличие клеток подозрительных на малигнизацию при цитологическом исследовании, использование в течение последних 6 месяцев средств гормональной контрацепции и заместительной гормональной терапии, беременность и лактация в течение последних 2 лет до исследования. Группу сравнения (2 группа) составили 28 женщин в возрасте от 35 до 55 лет (45±10 лет) с различными формами диффузной фиброзно-кистозной мастопатии, отказавшиеся от лечения и находящиеся на динамическом наблюдении.
Для постановки диагноза диффузная фиброзно-кистозная мастопатия мы использовали данные клинического исследования и классификацию Н. И. Рожковой [4], которая выделяет формы с преобладанием железистого компонента (аденоз), фиброзного, кистозного компонентов и смешанную форму ДФКМ. Степень выраженности диффузной мастопатии мы определяли при ультразвуковом исследовании по изменению толщины паренхимы по отношению к возрастной норме (по Солнцевой И. А). При этом, незначительно выраженная диффузная мастопатия характеризуется увеличением толщины паренхимы на 3-7 мм по отношению к средним показателям возрастной группы, умеренно выраженная - на 8-12 мм, резко выраженная - на 13-18 мм. Возрастная норма для женщин в возрасте от 35 до 44 лет составляет 10,5мм±2,5мм, от 45 до 55 – 7,8мм±1,9мм [5].
После постановки диагноза диффузной фиброзно-кистозной мастопатии пациенткам исследуемой группы было назначено лечение, включающее фитопрепараты, витаминотерапию, йодотерапию, иммуномодуляторы, седативные препараты, гепатопротекторы. Курс лечения составил 6 месяцев. Оценка эффективности лечения проводилась через 1, 3, 6, 9 и 12 месяцев по ультразвуковым и допплерграфическим критериям, через 12 месяцев проводилась оценка маммографических критериев.
Для обработки полученных данных мы использовали методы описательной статистики, включающие в себя оценку среднего арифметического (М), среднюю ошибку средней арифметической (m), среднюю ошибку среднего значения (t). Для оценки межгрупповых различий значений признаков применяли t-критерий Стьюдента.
Результаты и обсуждение: цитологическое исследование было проведено 94 (61,3%) пациенткам основной группы, из них у 37 (39,4%) пациенток исследовали отделяемое из соска, 26 (27,7%) пациенткам проведена ТАБ кист с последующим цитологическим исследованием аспирата, 31 (32,9%) женщине проведено цитологическое исследование отделяемого из соска и проведена ТАБ кистозных образований.
По данным цитологического исследования признаки пролиферации (высокая общая клеточность мазка, наличие клеточных комплексов железистого эпителия с единичными фигурами правильных митозов, разволокнение хроматина, увеличение количества ядрышек, участки перинуклеарных просветлений, вакуолизация цитоплазмы) были выявлены в 26 (27,7%) случаях. Эти изменения были выявлены в основном при мастопатиях с кистозным компонентом (12 (46,2%)) и выраженных аденозах (7 (26,9%)).
По данным рентгено-ультразвукового исследования, выявленные мастопатии были распределены в зависимости от формы и степени выраженности. Распределение ДФКМ по форме и степени выраженности представлено в табл. 1.
Таблица 1. Распределение диффузных мастопатий в зависимости от формы и степени выраженности в двух группах
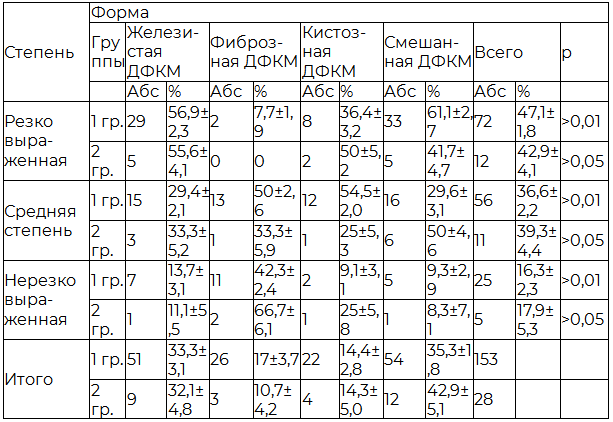
Примечание: р – уровень значимости.
В основной группе чаще всего выявлялись ДФКМ смешанной формы – у 54 (35%) женщин и с железистым компонентом – у 51(33,3%) женщины, по степени выраженности преобладали резко выраженные – у 72 (47,1%) пациенток и средней степени у 56 (36,6%). Именно эти формы по нашим наблюдениям имеют наиболее яркую клиническую симптоматику. Так, масталгию и мастодинию испытывали 112 (73,2%) женщин, выделения из одного или двух сосков различного характера (молозивные, зеленоватые, сероватые и т.д.) наблюдались у 57 (37,3%) пациенток. При пальпаторном исследовании уплотнение и неоднородность структуры молочной железы отмечались у 134 (87,6%) пациенток. В группе сравнения ДФКМ смешанной формы - 12 (42,9%) пациенток и с железистым компонентом – 9 (32,1%) так же встречались наиболее часто, но клинические проявления, такие как масталгия и мастодиния определялись реже – у 8 (28,6%), что, зачастую, и служило поводом отказа от лечения.
Оценка маммограмм была проведена по следующим качественным и количественным признакам: интенсивность тени железистого треугольника (интенсивная, средняя, малая), структура (однородная, неоднородная), соотношение жировой и железистой ткани (преобладает железистая, равное количество жировой и железистой ткани, преобладает жировая ткань), мелкоочаговые тени соответствующие участкам лобулярной гиперплазии (множественные (более 10), единичные (до 10)), очаговые тени, соответствующие кистам ≤ 10 мм, фокусные тени, соответствующие кистам более 10 мм.
В основной группе до лечения высокая интенсивность железистого треугольника, характерная для плотной железистой ткани определялась в 97 (61%) случаях исследования, неоднородность присутствовала в 134 (84,3%) маммографических изображениях. В 38 (28,4%) случаях неоднородность была обусловлена наличием мелкоочаговых теней, соответствующих участкам лобулярной гиперплазии, в 24 (17,9%) наличием очаговых и фокусных теней, соответствующих кистам, в 72 (53,7%) наблюдениях определялось сочетание данных признаков. В 65 (40,9%) случаях неоднородность ткани была обусловлена наличием утолщенных связок Купера, которые хаотично пересекали ткань молочной железы. Преобладание железистой ткани определялось у 86 (54,1%) пациенток. Стоит отметить, что выраженность железистого компонента на маммограммах не всегда соответствовала наличию гиперплазии железистой ткани при последующем ультразвуковом исследовании и, напротив, даже при рентгенологически малой выраженности железистого компонента при УЗИ мы выявляли признаки гиперплазии железистой ткани. В связи с этим мы считаем, что для точной инструментальной диагностики гиперпластических процессов молочной железы у женщин в возрасте от 35 лет необходимо проводить как маммографическое, так и ультразвуковое исследование.
При анализе маммограмм в группе сравнения высокая интенсивность определялась в 17 случаях (60,7%), неоднородность структуры в 23 (82,1%), преобладание железистой ткани в структуре в 16 (57,1) случаях, выраженный фиброзный компонент в виде утолщенных связок Купера наблюдался у 13 (46,4%) пациенток.
При ультразвуковом исследовании в двух группах нами были оценены следующие признаки диффузной мастопатии: гиперплазия железистой ткани (изменение толщины железистой ткани по отношению к возрастной норме), количество и размеры кист, дуктоэктазии, изменение эхогенности железистой ткани (повышение – приближение к эхогенности связок Купера, снижение – приближение к эхогенности протоков), неоднородность структуры железистой ткани, утолщение связок Купера более 1 мм. Все вышеперечисленные признаки были оценены через 1,3,6,9 и 12 месяцев.
По данным УЗИ при выявлении диффузной мастопатии в 1 группе гиперплазия железистой ткани определялась у 137 (86,2%) пациенток, кисты различного количества и размеров у 94 (59,1%), дуктоэктазии встречались в 72 (45,3%) случаях, изменение эхогенности железистой ткани имелось в 117 (73,6%) наблюдениях, неоднородность структуры в 125 (78,6%), утолщение связок Купера более 1 мм в 69 (43,4%) наблюдениях.
В группе сравнения гиперплазия железистой ткани определялась у 21 (75%) пациентки, кисты различного количества и размеров у 23 (82,1%), дуктоэктазии встречались в 25 (89,3%) случаях, изменение эхогенности железистой ткани наблюдалось в 21 (75%) случае, неоднородность структуры в 25 (89,3%), утолщение связок Купера более 1 мм в 14 (50%) случаях.
При допплерографическом исследовании регистрация кровотока в маммарных артериях не всегда возможна [2]. Учитывая, что исследование проводилось в 1 фазу менструального цикла, у большего числа женщин артерии паренхимы не визуализировались. Допплерография артерий паренхимы молочной железы с использованием высокочувствительного допплеровского режима была проведена 51 (32,1%) пациентке основной группы, причем визуализация артерий была возможна в основном при резко выраженных формах диффузной фиброзно-кистозной мастопатии с железистым и кистозным компонентом. Так же именно в этих случаях при цитологическом исследовании определялись признаки пролиферации.
Артерии паренхимы в нашем исследовании обычно определялись в верхненаружных квадрантах в количестве от 1 до 5 в каждой молочной железе. При анализе спектрограмм все они имели магистральный тип кровотока с низким периферическим сопротивлением, определялись симметрично в обеих молочных железах. У 16 (31,4%) пациенток показатели кровотока оказались в пределах нормы (Vmax.sist от 10 до 16 см/сек, RI от 0,55 до 0,75 и PI < 1,0), у 23 (45,1%) пациенток на фоне сохранения нормальных значений максимальной скорости отмечалось снижение RI до 0,42 и повышение PI до 8,0. В 12 (23,5%) случаях отмечалось повышение максимальной систолической скорости до 28-33 см/сек, снижение RI до 0,28-0,45 и повышение PI до 9,0-13,0. Мы связываем изменение скоростных показателей, сосудистого и периферического сопротивления с явлениями неоангиогенеза и пролиферации ткани молочной железы.
При ультразвуковом исследовании пациенток основной группы через 1 месяц от начала лечения отмечается незначительная положительная динамика, так гиперплазия железистой ткани уменьшается у 6 (4,4%) пациенток, структура железистой ткани расценена как более однородная у 9 (7,2%) пациенток.
При оценке ультразвуковых критериев через 3 месяц после лечения уменьшение гиперплазии железистой ткани отмечается у 42 (30,7%) пациенток, уменьшение количества кист у 26 (27,7%) пациенток, причем больший эффект отмечался при кистах до 10 мм (37,5%), так же уменьшилось количество расширенных протоков (дуктоэктазий) в 21 (29,2%) случае. Нормализация эхогенности железистой ткани была достигнута у 36 (30,8%) пациенток.
Через 6 месяцев лечения гиперплазия железистой ткани определялась у 43(31,4%) пациенток, а в 94 (68,6%) случаях толщина железистой ткани достигла нормальных возрастных показателей. Количество кист молочных желез уменьшилось у 66 (50,4%) пациенток. Следует отметить, что хорошо поддавались лечению, как единичные, так и множественные кисты, размером до 10 мм, более крупные кисты, зачастую, на фоне лечения оставались без изменений. У 27 (71,1%) пациенток с кистами более 10 мм после проведения аспирации и назначения лечения, рецидива заполнения кисты не произошло. Дуктоэктазии молочных желез определялись у 28 (38,9%) пациенток, причем лечению лучше поддавались единичные – 30 (41,7%) случаев. Эхогенность железистой ткани оценена как изоэхогенная у 65 (55,6%) пациенток, у 71 (56,8%) - структура железистой ткани приобрела однородность после 6 месяцев лечения.
После окончания 6-тимесячного курса лечения все пациентки были поставлены на динамическое наблюдение, которое было проведено через 9 и 12 месяцев после начала терапии. Через 9 месяцев мы наблюдали продолжение положительного терапевтического эффекта, так, нормализация толщины пласта железистой ткани наблюдалась еще у 9 (6,6%) пациенток, уменьшилось количество единичных кист у 18 женщин (16,5%), так же продолжалась нормализация эхогенности и структуры железистой ткани – у 16 (13,7%) и 22 (17,6%) пациенток соответственно.
При динамическом допплерографическом исследовании через 3 месяца после начала лечения показатели значений достоверно не менялись. Только при контроле через 6 месяцев у 34 (66,7%) пациенток спектральные показатели кровотока были оценены как нормальные. Через 9 месяцев еще у 6 (11,8%) женщин нормализовались допплерометрические значения. При контрольном исследовании через 1 год от начала лечения мы отметили увеличение скоростных показателей и снижение значений RI и PI у 4 (7,8%) пациенток при рецидивирующем течении ДФКМ.
Очень важным, на наш взгляд, является контрольное комплексное рентгено-ультразвуковое исследование через 6 месяцев после окончания лечения. У 24 (17,5%) пациенток был выявлен рецидив гиперплазии железистой ткани, у 4 (3,1%) увеличилось количество кист и дуктоэктазий, в 18 (15,4%) случаях изменилась эхогенность железистой ткани. Стойким оказался терапевтический эффект в отношении однородности структуры железистой ткани и толщины связок Купера. Выявленная отрицательная ультразвуковая динамика была расценена как рецидивирующее течение диффузной фиброзно-кистозной мастопатии, которое требует постоянного наблюдения, повторных курсов или коррекции схемы лечения. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез на фоне лечения представлен на рис. 1.
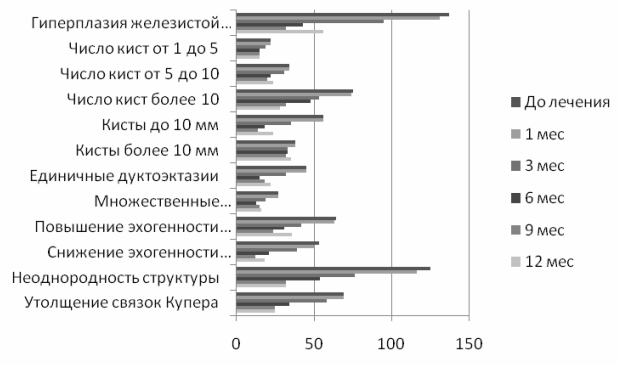
Рис. 1. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез на фоне лечения.
При динамическом сравнении маммограмм, выявлено, что через год интенсивность железистого треугольника от высокой изменилась до средней и малой в 34 (35,1%) случаях. Структура определялась как более однородная на 62 (46,3%) маммограммах, причем однородность достигалась в 18 (29%) случаях за счет отсутствия мелкоочаговых теней, соответствующих участкам лобулярной гиперплазии, в 13 (21%) отсутствием очаговых и фокусных теней, соответствующих кистам, в 31 (50%) наблюдении отсутствием как признаков лобулярной гиперплазии, так и кистозных изменений.
При анализе изменений в молочных железах у пациенток группы сравнения по данным УЗИ мы отметили отрицательную динамику. Так, гиперплазия железистой ткани и количество кист увеличились у 3 (10,1%) женщин, эхогенность железистой ткани снизилась у 4 (14,3%). Усиление клинической симптоматики отметили 5 (17,9%) пациенток. При анализе маммограмм рентгенологическая картина через год была оценена, как стабильная. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез без лечения представлен на рис. 2.
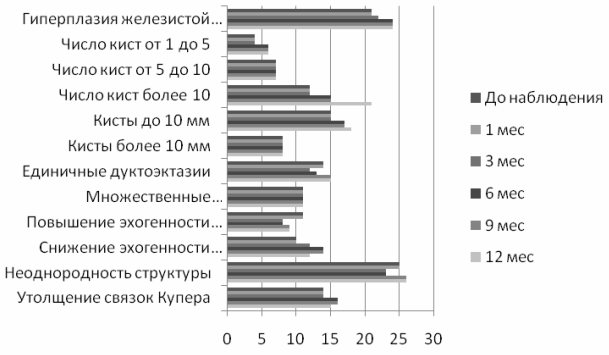
Рис. 2. Мониторинг ультразвуковых критериев диффузных гиперпластических процессов молочных желез без лечения.
Выводы
1. На основании вышеизложенного, по данным нашего исследования, определены маммографические критерии оценки эффективности лечения диффузных гиперпластических процессов молочной железы, это: уменьшение интенсивности тени железистого треугольника, количества мелкоочаговых теней, соответствующих участкам лобулярной гиперплазии, количества очаговых и фокусных теней, соответствующих кистам, уменьшение толщины связок Купера до ≤1 мм, а также однородность структуры железистой ткани в динамике.
2. Ультразвуковыми критериями оценки эффективности лечения явились: уменьшение толщины железистой ткани до нормальных возрастных показателей, толщины связок Купера до ≤1 мм, уменьшение диаметра и количества кист, дуктоэктазий, а так же нормализация эхогенности железистой ткани и ее однородность в динамике.
3. Допплерометрическими критериями эффективности лечения могут служить: уменьшение количества артерий в паренхиме молочных желез, снижение повышенной максимальной систолической скорости Vmax.sist до 11-16 см/сек, повышение значений RI до 0,55-0,75 и снижение PI до 1,0. Мы считаем, что допплерография в оценке эффективности лечения ДФКМ является перспективной и требует дальнейшего исследования.
4. Для диагностики, дифференциальной диагностики и оценки эффективности лечения диффузных гиперпластических процессов молочных желез необходимо тесное сотрудничество врачей онкологов, маммологов с врачами лучевой диагностики. У женщин в возрасте от 35 до 55 лет следует применять комплексное клиническое, лабораторное, маммографическое, ультразвуковое и допплерографическое исследование, с обязательным поэтапным контролем вышеуказанными методами в течение года, для своевременной диагностики рецидивирующих форм диффузных фиброзно-кистозных мастопатий с явлениями пролиферации, определения эффективности или неэффективности проводимого лечения, с целью коррекции или пролонгации назначенной терапии.
