Введение. Фиброз печени при прогрессировании может привести к циррозу, так что его раннее выявление является важной задачей. Стадирование фиброза также имеет существенное значение для прогнозирования и тактики ведения. Цирроз, а также часто предшествующие ему вирусные гепатиты, являются главными факторами риска развития гепатоцеллюлярного рака [2]. Биопсия печени известна как «золотой стандарт» в диагностике фиброза печени. Тем не менее, биопсия печени также имеет значительные ограничения, связанные с малым количеством образцов для исследования, субъективной патологоанатомической трактовкой и риском развития пост-биопсийных кровотечений. Поэтому, постоянно оцениваются другие методы, которые в состоянии неинвазивно оценить фиброз печени. До настоящего времени большинство исследователей применяют транзиентную эластографию и серологические маркеры фиброза [8].
ARFI (acoustic radiation force impulse) технология изучается для ее использования в различных клинических областях, в том числе и для оценки диффузных заболеваний печени [3]. Сообщается, что имеется высокая корреляция между ARFI эластографией и транзиентной эластографией со стадиями фиброза [6]. При ARFI используется короткий по продолжительности акустический импульс непосредственно при проведении исследования в В-режиме, для того, чтобы произвести ограниченные смещения в тканях. При этом можно получить количественную оценку скорости распространения сдвиговой волны в паренхиме печени, и чем менее эластичны ткани, тем выше скорость [4]. В литературе только начинают появляться новые публикации, и накапливаться информация о применении ARFI эластометрии для определения фиброза печени.
Целью нашей работы является оценить возможности количественной эластографии сдвиговой волной в определении фиброза печени у онкологических больных.
Материалы и методы. В основу работы положен анализ данных ультразвукового исследования печени 100 больных за период с 2012 по 2013 г. в ФГБУ «РОНЦ имени Н.Н. Блохина» РАМН. Возраст больных колебался от 19 до 77 лет, средний возраст составил 54 года; женщин было 45, мужчин – 55. Диагноз злокачественных новообразований поставлен 96, доброкачественных – 4 пациентам. Цирроз установлен 18 больным, в 10 случаях диагноз был подтвержден гистологически с определением стадии F4 по шкале Metavir, в остальных случаях диагноз основывался на клинико-лабораторных данных и результатах лучевых методов исследования. Стадии фиброза по Metavir определялись при гистологическом исследовании резецированного материала у 32 пациентов: F0 – фиброза нет (14 случаев), F1 - звездчатое расширение портальных трактов без образования септ (5 случаев), F2 - расширение портальных трактов с единичными портопортальными септами (2 случая), F3 - многочисленные портоцентральные септы без цирроза (1 случай), F4 – цирроз (10 случаев). Вирусные гепатиты были отмечены у 16 больных, из них гепатит В - у 10, а гепатит С - у 6 больных. Цирроз формировался на фоне гепатита в 11 случаях, гепатит без цирроза встречался у 5 больных.
Всем 100 больным проводилась эластометрия сдвиговой волной в ткани печени для определения фиброза печени. Больные, которым проводилось измерение скорости сдвиговой волны в паренхиме печени, распределились следующим образом: гепатоцеллюлярный рак (ГЦР)– 42, холангиоцеллюлярный рак (ХЦР) – 9, метастазы колоректального рака – 27, метастазы рака других локализаций – 18, доброкачественные образования – 4 случая. Доброкачественные новообразования включали в себя две фокальные нодулярные гиперплазии, одну гепатоцеллюлярную аденому и одну кавернозную гемангиому больших размеров. Верификация диагноза была достигнута гистологическим исследованием материала, полученного при тонкоигольной аспирационной биопсии под ультразвуковым контролем, либо при оперативной резекции печени у 91 больных. У остальных 9 больных диагноз, при наличии очаговых образований, подтверждался РКТ и МРТ с внутривенным контрастированием.
Эластография сдвиговой волной была выполнена на ультразвуковом аппарате Acuson S2000 (Siemens, Германия) при помощи конвексного датчика с использованием технологии ARFI. Количественное измерение скорости сдвиговой волны также носит название эластометрии. Положение больного при проведении исследования печени – лежа на левом боку с отведенной за голову правой рукой. Осмотр осуществлялся при положении датчика в межреберьях параллельно проекции ребра и перпендикулярно поверхности кожи, без выраженного давления на ткани, при задержке дыхания. При исследовании паренхимы печени выбиралось окно, свободное от сосудов и протоков, проводилось измерение скорости сдвиговой волны (эластометрия) не менее 10 раз, замеры скоростных величин совершались аппаратом автоматически в м/с.
Наши данные были внесены в программу Microsoft Excel, а статистическая обработка выполнена с использованием программы MedCalc, GraphPad, а также с применением ROC -анализа. Количественные параметры были представлены в виде максимальных, минимальных и средних значений, медианы. Оптимальные пороговые значения были выбраны при максимальной сумме чувствительности и специфичности. Различия между группами считались достоверными при p≤0,05.
Результаты. Эластометрия печени проведена всем больным для определения скоростных показателей при неизмененной печени, а также при циррозе и гепатите (рис. 1, 2).
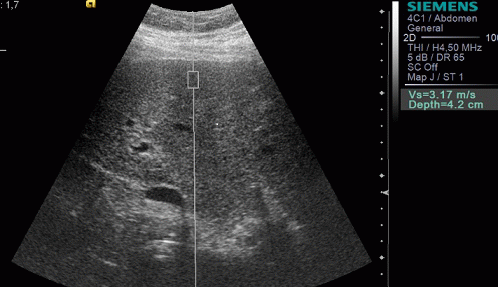
Рис. 1. Эластометрия печени у больного с циррозом печени.
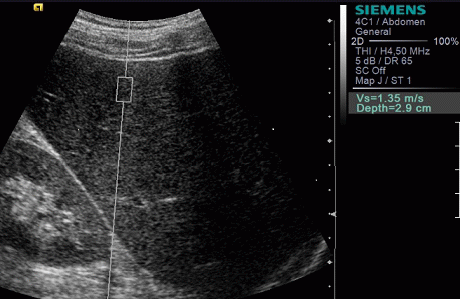
Рис. 2. Эластометрия печени у больного без цирроза печени.
Произведено сравнение результатов, полученных при ARFI эластометрии печени у всей группы больных (n=100) – группа 1, при циррозе (n=18) – группа 2, гепатите без цирроза (n=5) – группа 3, больных без цирроза и гепатита (n=77) – группа 0, она условно обозначена группой здоровых. Всего отмечалось 16 больных с гепатитом В (n=10) и С (n=6), но у 11 из них отмечался цирроз печени, поэтому всего 5 случаев гепатита были рассмотрены для определения скоростных характеристик. Распределение значений эластометрических показателей печени показано на рис. 3.
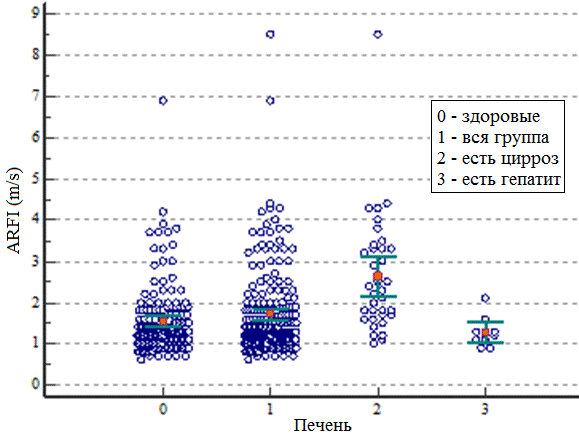
Рис. 3. Точечное распределение эластометрических показателей печени.
На рис.3 показано, что средние значения (отмечены оранжевыми точками) при циррозе превышают данные всех остальных групп и, наоборот, при гепатите средние значения самые низкие. Результаты эластометрии сдвиговой волны в печени представлены в табл. 1.
Таблица 1. Результаты эластометрии сдвиговой волной в печени
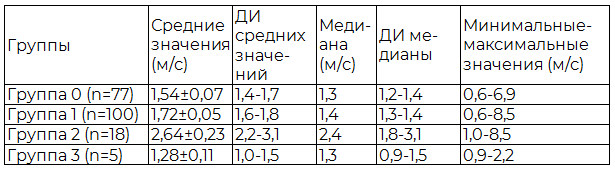
Из табл. 1 видно, что медиана, средние и максимальные значения при циррозе превышали такие же показатели других групп. На рис.4 показаны значения эластометрических показателей печени.
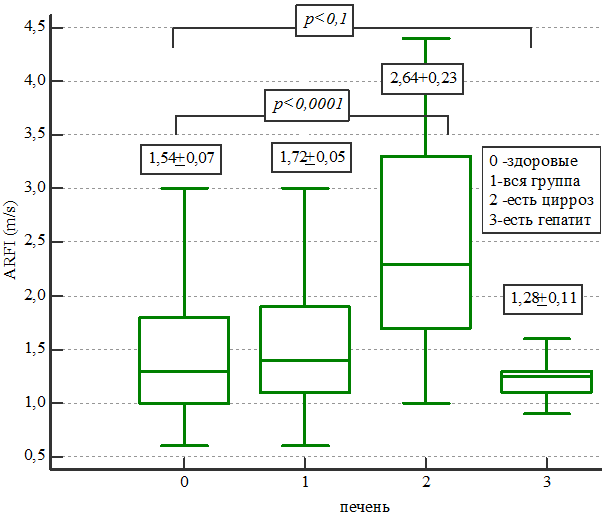
Рис. 4. Распределение эластометрических показателей печени.
Показаны результаты средних значений в виде поперечной линии в боксах и цифровых значений над боксами. Размах между максимальными и минимальными значениями обозначен поперечными линиями в конце отрезков. Сами боксы представляют собой графическое изображение интерквартильного размаха – это интервал между 25 и 75 процентилями, когда четверть всех значений признака меньше 25 процентили, а четверть – больше 75 процентили. Таким образом, интерквартильный размах содержит «центральные» 50% значений признака и для описанных групп составил: 1,0-1,8 м/с (для группы 0), 1,1-1,95 м/с (для группы 1), 1,7-3,3 м/с (для группы 2), 1,1-1,3 м/с (для группы 3). Различия между группами больных с циррозом и неизмененной паренхимой печени были статистически значимыми (р <0,0001), но нам не удалось получить достоверных различий между группами с гепатитом и неизмененной паренхимой (р <0,1), что объясняется небольшим количеством больных в группе 3. ROC-кривая информативности теста в определении цирроза представлена на рис. 5.
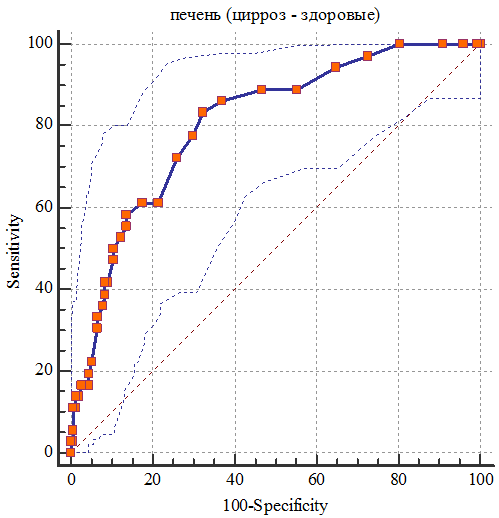
Рис. 5. ROC кривая информативности теста в определении цирроза.
AUC (площадь под кривой) составила 0,805±0,03, 95% доверительный интервал (ДИ) 0,742-0,859, P<0,0001. При определении пороговых значений в диагностике цирроза, показатели чувствительности и специфичности, которые в суммарном исчислении показали наибольшее число получены при значении >1,5 м/с, где чувствительность 80%, а специфичность – 69%. При высокой специфичности в 98,7% оптимальное пороговое значение составляет >3,9 м/с с чувствительностью 13,9%.
У 32 больных гепатоцеллюлярным раком при гистологическом исследовании после резекции печени проведена оценка печени по шкале METAVIR от F0 до F4. Количество больных с фиброзом F0 составило 14, F1 – 5, F2 – 2, F3 – 1, F4 – 10, и поскольку случаев фиброза F1-2-3 наблюдалось немного, поэтому для статистического анализа эти группы были объединены (n=8). Результаты эластометрии сдвиговой волной в печени в зависимости от стадии цирроза по METAVIR представлены в табл. 2.
Таблица 2. Результаты эластометрии сдвиговой волной в печени в зависимости от стадии цирроза по METAVIR
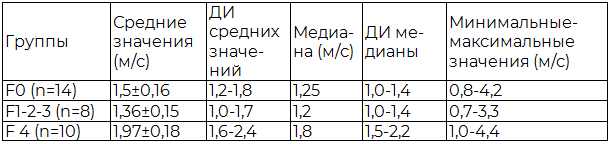
Видно, все показатели при циррозе печени (F4) были самыми высокими. Средние значения в группе F1-2-3 были ниже, чем в группе F0, а показатели минимальных и максимальных значений входили в интервал при отсутствии фиброза. Графические результаты эластометрических показателей печени в зависимости от стадии фиброза представлены на рис. 6.
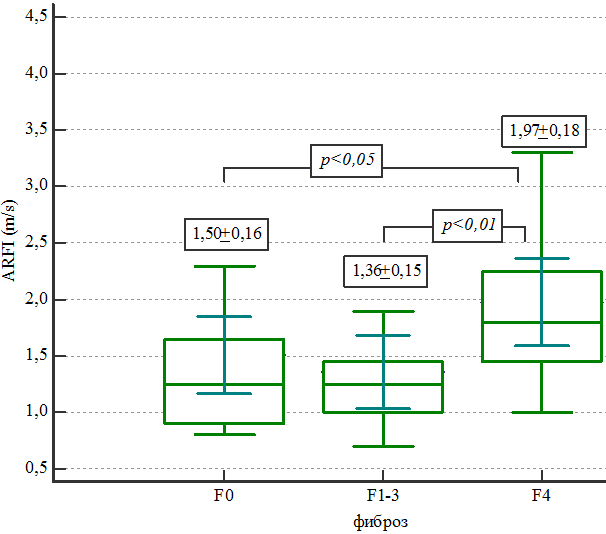
Рис. 6. Эластометрические показатели паренхимы печени в зависимости от стадии фиброза.
Интерквартильный размах составил: 0,9-1,6 м/с (для группы F0), 1,0-1,4 м/с (для группы F1-2-3), 1,4-2,2 м/с (для группы F4). Различия между группой с циррозом печени (F4) и другими группами были статистически значимыми (р<0,05). ROC-кривая информативности в определении цирроза представлена на рис. 7.
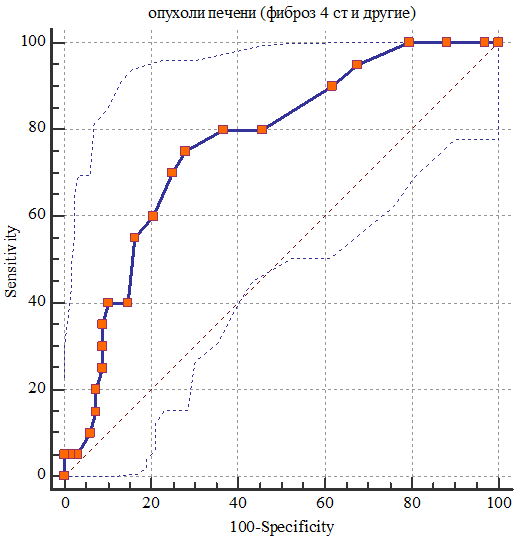
Рис. 7. ROC кривая информативности в определении стадии F4.
AUC (площадь под кривой) составила 0,766±0,06, 95% доверительный интервал (ДИ) 0,663-0,850, P<0,0001. При определении пороговых значений в диагностике цирроза, показатели чувствительности и специфичности, которые в суммарном исчислении показали наибольшее число получены при значении >1,4 м/с, при этом чувствительность составила 75%, а специфичность – 72%. При повышении порогового значения до 2,0 м/с, чувствительность составила 35%, но зато специфичность 91%. Оптимальным же критерием назначены показания свыше 4,2 м/с, при этом специфичность достигает 100%, хотя чувствительность снижается до 5%.
Обсуждение. Фокусированный акустический импульс (ARFI) - вторая после транзиентной эластографии ультразвуковая методика для оценки фиброза печени в клинических условиях. Преимущество ARFI по сравнению с транзиентной эластографией заключается в том, что одновременно на экране имеется обычное ультразвуковое изображение, измерение скорости проводится в выбранном окне, поэтому результаты не зависят от толщины подкожно-жировой клетчатки, асцита [11]. Было показано, что точность обеих методик в диагностике цирроза печени была одинаковой [12]. Sporea I. и др. сравнили разные эластографические методики в отношении их возможностей при оценке фиброза печени. Значительно более высокий процент надежных измерений был получен с использованием ARFI (р <0,0001) [13]. В рекомендациях Европейской Федерации обществ по ультразвуку в медицине и биологии (EFSUMB) говорится, что ARFI может использоваться для оценки фиброза печени ARFI могут быть использованы для оценки тяжести фиброза печени у пациентов с хроническим вирусным гепатитом, особенно с гепатитом С [1].
Исследование рекомендуется проводить в 5-6-7-8- сегментах. Скоростные значения в паренхиме печени у здоровых, по данным разных авторов составили 1,1±0,22 м/с [5,7]. Наши данные показали более высокие значения скорости распространения сдвиговой волны в неизмененной паренхиме печени – 1,54±0,07, такие же результаты были получены при гистологическом подтверждении F0 - 1,5±0,16.
В исследовании, выполненном Lupşor M. и др. [9] были оценены 112 пациентов с хроническим гепатитом. Наблюдались следующие средние значения для различных стадий фиброза: 1.079 ± 0.150 м/с (F0-F1), 1.504 ± 0.895 м/с (F2), 1.520 ± 0.575 м/с (F3) и 2.552 ± 0.782 м/с (F4). Статистически достоверные различия имелись только между F3 и F4. Были предложены пороговые значения для стадий фиброза: F ≥ 1:1.19 м/с; F ≥ 2:1.34 м/с; F ≥ 3:1.61 м/с; и F ≥ 4:2 м/с. При нашем анализе, средние значения F4 составили 1,97±0,18 м/с, а значения F0 были в полтора раза выше. Возможно, это зависело от когорты пациентов – онкологические больные, у большинства имеются очаговые изменения в печени. В работе Park H, и др. при изучении ARFI эластографии новообразований печени тоже представлены высокие значения в окружающей новообразования паренхиме печени [10].
Отмечается вариабельность средних значений скорости в зависимости от стадий фиброза, каждый исследователь предоставляет свои значения, которые могут существенно разниться между собой. Так, в многоцентровом международном исследовании проанализированы измерения ARFI сдвиговой волной у 911 человек. Обнаружена высокая корреляция (r=0.654) между значениями ARFI и фиброзом (p<0.0001). Пороговые значения для стадий фиброза: F≥1 - 1.19 м/с (AUROC=0.779), F≥2 - 1.33 м/с (AUROC=0.792), F≥3 - 1.43 м/с (AUROC=0.829), F=4 - 1.55 м/с (AUROC=0.842). Корреляция между гистологически подтвержденным фиброзом и методами транзиторной и ARFI эластографией отличалась не существенно: r=0.728 против 0.689, p=0.28. Но для прогнозирования фиброза F≥1 и цирроза печени транзиторная эластография была более достоверной (p=0.01), чем ARFI [14]. В нашей работе ассоциированное пороговое значение для F4 было 1,4 м/с, с чувствительностью 75% и специфичностью 72%.
Выводы. Технология ARFI продемонстрировала высокую эффективность в диагностике цирроза печени. Средние значения скоростных показателей при циррозе печени превышают данные других групп, но отмечается весьма широкий диапазон минимальных и максимальных значений во всех исследуемых группах, что может поставить под сомнение практическую значимость эластографии сдвиговой волной (ARFI) в диагностике цирроза печени. Также не замечено повышение средних значений и медианы при промежуточных стадиях фиброза по сравнению с группой больных без фиброза. Поэтому необходимо продолжить клинические исследования для определения фиброза печени эластографией сдвиговой волной.
