Актуальность. Опухолевые поражения пищевода являются актуальной проблемой онкологии и хирургии [2]. Рак пищевода (РП) считается одним из наиболее неблагоприятных с прогностической точки зрения заболеваний желудочно-кишечного тракта [6]. Среди онкологических заболеваний РП занимает 9-е место и составляет около 2%. Заболеваемость РП распространена неравномерно от 4 до 35 случаев на 100 тыс. населения [8]. В последние десятилетия отмечается увеличение частоты рака диффузного и смешанного типов [4]. Возникновение РП связывают с особенностями питания, а также с употреблением алкоголя и курением табака. Одним из факторов способствующих возникновению заболевания является пищевод Барретта, который увеличивает риск развития РП в 30-40 раз [9]. С высокой частотой РП может диагностироваться также у пациентов с опухолевой патологией головы и шеи [5]. Большинство больных РП обращаются за врачебной помощью на поздних стадиях заболевания, когда проведение радикального хирургического лечения ограничено [3]. Оценка состояния пищевода и патологических изменений окружающих тканей у больных с РП после хирургических вмешательств и в процессе химиолучевого лечения продолжает оставаться важной проблемой онкологии.
Диагностику РП осуществляют лучевыми и клинико-инструментальными методами исследования, оценивая местную и отдаленную распространенность опухолевого процесса [12]. При оценке распространенности опухоли обращают внимание на размер опухоли, наличие инвазии в стенку, возможное прорастание в окружающую жировую клетчатку и поражение регионарных лимфатических узлов, а так же наличие отдаленных метастазов. В зависимости от характера лимфогенного метастазирования четвертая стадия РП разделяется на IVa и IVb [11]. Окончательный диагноз РП устанавливается после морфологического исследования строения опухоли. Традиционно всем больным РП проводят рентгенологическое исследование пищевода с бариевой взвесью и эзофагоскопию с биопсией. В целях уточнения степени распространения опухоли выполняют спиральную компьютерную томографию (СКТ) грудной клетки, а также верхних отделов брюшной полости [10]. Перспективным методом оценки распространенности процесса является позитронная эмиссионная томография (ПЭТ), которая позволяет в одном исследовании определить наличие синхронной опухоли и метастазов [1].
В последние годы все большее значение в распознавании патологии желудочно-кишечного тракта приобретает УЗИ, что связано с появлением новых ультразвуковых аппаратов обладающих высокой разрешающей способностью и тканевой чувствительностью. Метод не является инвазивным и не имеет побочных эффектов. Основные ограничения применения УЗИ связаны с узким полем зрения, что снижает восприятие получаемого изображения, особенно у тучных пациентов. Разработанные на сегодняшний день методики УЗИ используемые в гастроэтерологии в основном направлены на диагностику заболеваний желудка и кишечника [7]. Вопросы ультразвуковой диагностики новообразований пищевода, особенно средней его трети освещены недостаточно, что позволило предположить целесообразность проведения детального изучения возможностей УЗИ при опухолевых поражениях пищевода на разных стадиях заболевания и в процессе проводимого лечения.
Цель исследования - Изучение современных возможностей и повышение эффективности ультразвуковой диагностики опухолей пищевода, а также оценки его состояния в процессе применения комбинированных методов лечения.
Материал и методы исследования. Возможности ультразвуковой диагностики РП на всем его протяжении изучали на аппаратах экспертного класса Logiq S9 GE и Aplio MX Toshiba Исследование выполняли высокочастотными датчиками в В-режиме серой шкалы с использованием правого парастернального, супрастернального и гипогастрального доступов. Результаты оценивали в режиме «кино-петли». Применение допплеровских режимов в сочетании с контрастированием просвета позволяло дифференцировать новообразование пищевода, оценить его размеры и структуру, изучить строение стенок.
С подозрением на новообразования пищевода ультразвуковым методом обследовано 180 пациентов, из них: эзофагиты – 45, дивертикулы пищевода – 24, ахалазия пищевода – 12, химические ожоги – 4, грыжи пищеводного отдела диафрагмы - 14. В контрольную группу вошли 30 пациентов, у которых патологических изменений пищевода выявлено не было. С верифицированным диагнозом РП обследован 102 пациент 66(64,7%) мужчин и 36(35,3%) женщин в возрасте от 36 до 88 лет средний возраст 64,5±4,7 года, госпитализированных в клинику для проведения химиолучевого лечения. Среди больных РП преобладали мужчины, в возрасте 50-59лет, составившие 73% обследованных. В основном больные поступали через 6-12 месяцев от начала клинических проявлений заболевания, что было связано с поздним обращением, ошибками в диагностике и длительным консервативным неспецифическим лечением. Все пациенты были неоднократно обследованы УЗИ от 3-х до 6 раз по определенной программе, включающей первичное обследование при поступлении, в середине курса проводимой терапии и по окончании лечения.
У большинства имелась сопутствующая патология. Преобладали заболевания сердечно-сосудистой системы, которые были диагностированные - у 75% больных. При поступлении в клинику 69 пациентов были в удовлетворительном состоянии и 12 в состоянии средней тяжести, что составило 79% больных.
У всех больные с РП была определена преимущественная локализация опухоли, которую устанавливали по наиболее выраженному уровню стенотического сужения пищевода и набольшему объему выявленного патологического образования.
Распределение больных раком пищевода с учетом их локализации представлено на рис. 1.
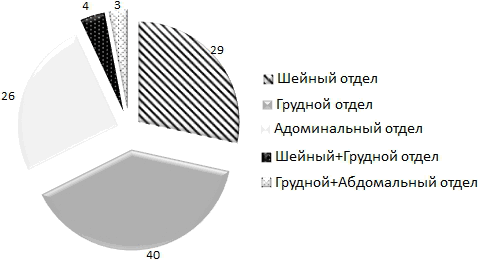
Рис.1. Распределение больных раком пищевода с учетом их локализации.
У 29(28,4) больных была поражена верхняя треть пищевода, у 40(39,2%) среднегрудной отдел и у 26(25,5%) пациентов был рак нижней трети, у 4(3,9%) больных были поражены шейный + грудной отдел, у 3(2,9%) - грудной + абдоминальный отделы. Как видно наиболее часто поражался грудной отдел пищевода.
В результате проведенного комплексного клинико-лучевого обследования у больных РП была установлена стадия заболевания. Распределение по стадиям заболевания представлено в табл. 1.
Таблица 1. Распределение больных раком пищевода по распространенности патологического процесса
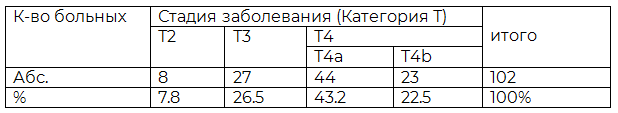
В обследованной группе больных РП не было пациентов с I стадией заболевания. Вторая стадия диагностирована у 8(7,8%) пациентов. Наибольшее количество больных 94(92,6%) было с Т3 и Т4 стадией заболевания. Все они получали комбинированное химиолучевое лечение. Отдаленные метастазы главным образом в печень, кости и легкие были диагностированы у 18(22,2%) пациентов. В нашем исследовании пациенты с 3 и 4 стадией болезни поступали на лечение в 3 раза чаще, чем с более ранними стадиями.
По гистологическому типу у большинства больных 93(91,2%) диагностирован плоскоклеточный рак различной степени дифференцировки, у 9(8,8%) пациентов аденокарцинома и апластический рак.
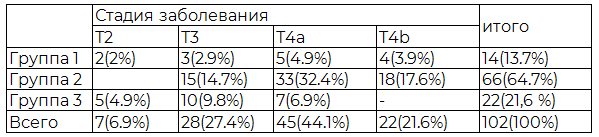
Все больные с РП были разделены на три группы в зависимости от анамнеза заболевания и характера ранее выполненного лечения. Первую группу составили 14(13.7%) больных с впервые выявленным заболеванием, проходивших амбулаторное обследование. Вторую группу составили 66 (64.7%) пациента с диагнозом рак пищевода III-IV стадии, имевшие тяжелую сопутствующую патологию, противопоказания к проведению радикального хирургического лечения, получавших паллиативную терапию. Третью группу составили 22(21,6%) пациента находившихся на химиолучевом лечении после ранее выполненных различных хирургических вмешательств.
Таблица 2. Распределение больных по стадиям заболевания в различных группах больных раком пищевода
Результаты и их обсуждение. Анализ ультразвуковой картины новообразований пищевода позволил выявить основные и дополнительные эхографические признаки заболевания. РП характеризовался наличием локального изоэхогенного утолщения одной или всех стенок, при этом наружный контур пищевода приобретал бугристый характер. Выявленное новообразование, связанное со стенкой имело преимущественное экзофитное в 30% или смешенное в 70% распространение.
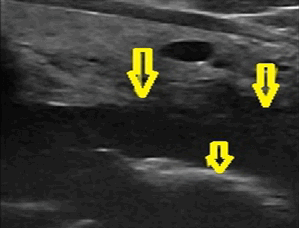
Рис. 2. Рак шейного отдела пищевода III стадия. Прорастание щитовидной железы.
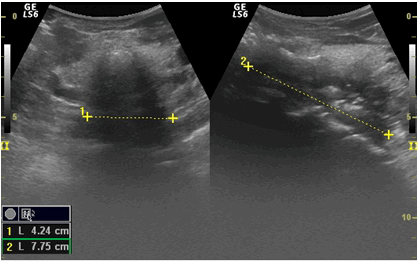
Рис. 3. УЗИ пищевода (поперечное и продольное сканирование). Экзофитный рак верхней трети пищевода.
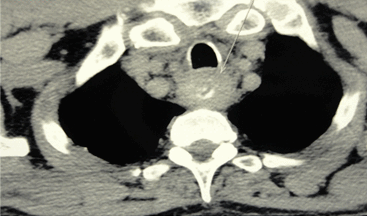
Рис. 4. СКТ пищевода того же больного.
Определяемые размеры опухоли были в пределах от 1,5 до 7,7см. Важным характерным отличием ультразвуковой картины при опухолевом поражении пищевода являлось нарушение строения его стенки. Дифференциация слоистого строения стенки определялось в группах 1 и 2, в то время как, у всех больных в 3 группе после оперативного лечения стенка визуализировалась как однородная, пониженной эхогенности. При этом центральная гиперэхогенная зона имела нечеткий контур. При поперечном сканировании из супрастернапьного доступа у больных РП средней трети выявлялся характерный для опухоли "синдром поражения полого органа", отчетливо дифференцировалась параэзофагеальная жировая клетчатка. В случаях стенотических сужений просвет пищевода не определялся. При стриктурах за тенью сердца определялся расширенный пищевод с тонкими стенками и неоднородным преимущественно гипоэхогенным содержимым. Максимальный размер расширенного пищевода в наших исследованиях составил 46мм. Престенотическое расширение хорошо визуализировались у больных раком нижней трети. При переходе опухоли на верхнюю треть желудка определялось утолщение кардиального отдела и прилежащих отделов желудка. Важным эхографическим признаком злокачественного поражения пищевода является ригидность его стенок с отсутствием смещения и расширения при глотании.
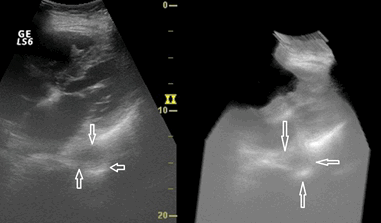
Рис. 5. УЗИ пищевода из правого парастернального доступа. Смешанная форма рака средней трети пищевода. Трехмерная реконструкция изображения.
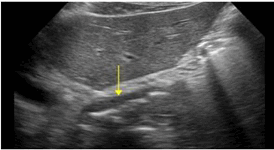
Рис. 6. Экзофитный рак нижней трети пищевода. Эпигастральный доступ.
Особенностями ультразвуковой визуализации пищевода у 5 пациентов 3-й группы, после проведения реконструктивных хирургических операций было наличие значительных переэзофагиальных рубцовых изменений, и отека окружающих тканей. У всех больных этой группы отчетливо визуализировался стабильно расширенный просвет пищевода, поперечный диаметр которого не зависел от приема жидкости. Симметричное утолщение стенок пищевода у этих больных более 30 мм, расценивалось как признак сопутствующего эзофагита. У 6 из 21 больного с поражением нижней трети пищевода определялся рефлюкс, который наблюдался в процессе исследования и характеризовался чередующимися забросами жидкости. У 4-х больных стадии Т4 УЗИ было выполненного после стентирования пищевода. В этих случаях была произведена ультразвуковая оценка его размеров, расположения и функционального состояния.
В зависимости от локализации опухоли и стадии заболевания была произведена оценка эффективности ультразвукового исследования.
Таблица 3. Эффективность ультразвукового исследования рака пищевода в зависимости от локализации опухоли и стадии заболевания
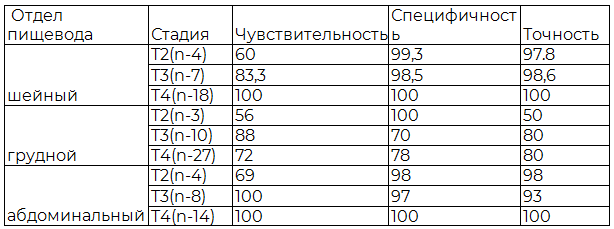
Эффективность УЗИ шейного отдела по показателям чувствительности в диагностике рака пищевода при любой стадии заболевания во всех случаях соответствовала 100%
Удовлетворительная и хорошая визуализация пищевода с его опухолевым поражением в средней трети была получена у 35 из 40 пациентов, что составило 87,5% этой группы
Удовлетворительная визуализация нижнего сегмента грудного отдела пищевода на протяжении 4,0-7,0 см была получена у 76% пациентов. С диагностической эффективностью приближающейся к 100% у пациентов с поражением абдоминального отдела.
У всех больных при любой локализации опухоли пищевода проводили оценку метастазтрования. Для этого в процессе обследования использовали все доступные ультразвуковые методики и ультразвуковые окна. Метастазы в лимфатические узлы были выявлены у 46 пациентов. При раке грудного отдела пищевода метастаз в надключичные лимфатические узлы были выявлены у 6 пациентов. При раке абдоминального отдела у 14 пациентов диагностированы увеличенные лимфатические узлы ворот печени и малого сальника.
В табл. 4 представлена частота выявленных пораженных лимфатических узлов различных групп в зависимости от первичной локализации РП.
Таблица 4. Частоты выявления поражения различных групп лимфатических узлов при УЗИ в зависимости от локализации первичной опухоли пищевода
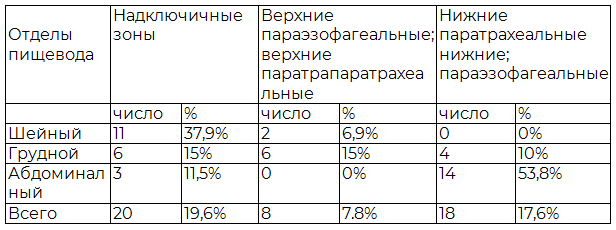
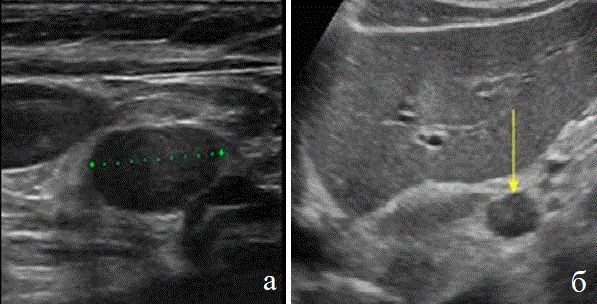
Рис. 7. Метастазы РП в лимфатических узлах. Лимфатические узлы: надключичная зона (а), брюшная полость (б).
Произведена оценка диагностической чувствительности и точности УЗИ пищевода в зависимости от стадии заболевания. Установлено, что наибольшие сложности в точности диагностики с максимальным разбросом данных возникают у больных в стадии Т2. При стадиях ТЗ-Т4 чувствительность достигает 90% и более.
Таблица 5. Эффективность УЗИ в диагностике рака пищевода в зависимости от стадии заболевания

Произведена оценка диагностической эффективности УЗИ относительно рентгенологического метода исследования и спиральной компьютерной томографии. Показано, что УЗИ, как альтернативный метод исследования, обладает соизмеримой диагностическая эффективность относительно других методов диагностики.
Таблица 6. Диагностическая эффективность различных методов исследования при раке пищевода

Проведенное исследование показывает достаточно высокую чувствительность УЗИ в диагностике РП при различных стадиях заболевания, немногим уступает СКТ и при этом точность возрастает при новообразованиях больших размеров. СКТ обладает более высокими возможностями при определении распространенности поражения.
УЗИ выполненное по окончании курса химиолучевого лечения показало, что полный эффект, то есть исчезновение всех опухолевых образований, был зарегистрирован у 53(65,4%) больных обследованной группы. В то время как, без эффекта отмечалось у 15(18,5%), а у 13(16,0%) было отмечено прогрессирование заболевания. Результат химиолучевой терапии напрямую был связан со стадией заболевания. Наши исследования подтверждают ранее известные данные, что эффективность лечения в наибольшей степени зависит от объема опухоли, состояния регионарных лимфатических узлов, а также от таких показателей как скорость регресса опухоли и степени вовлечения лимфатических узлов, окружающих органов и тканей.
Выводы. УЗИ является альтернативным методом лучевого обследования больных РП. Его применение эффективно в оценке осложнений опухолевого процесса и может быть использовано на всех этапах проводимого лечения. Результаты проведенной работы позволили уточнить ультразвуковую семиотику различных форм РП, определить диагностическую значимость отдельных симптомов и их сочетаний и выработать рациональную программу обследования больных.
