Оценка активации системы гемостаза позволяет определить риск развития тромботических и геморрагических осложнений, составить план профилактики, мониторировать действие назначаемых препаратов. В произведенных ранее исследованиях (в том числе и многоцентровых рандомизированных) оценивалось в основном коагуляционное звено системы гемостаза: была определена активация свертывающей системы, выявлена более высокая частота тромботических осложнений, по сравнению со здоровыми пациентами, была доказана необходимость проведения антикоагулянтной терапии в пред- и постоперационном периодах [1-4]. Созданные многочисленные рекомендации по проведению антикоагулянтной терапии в периоперационном периоде основываются на отнесении пациента к той или иной группе риска [5-7]. Это подразделение основывается на следующих признаках: тип операции (большой или малый), возраст (<40 лет, от 40 до 60 лет, >60 лет), наличие дополнительных факторов риска (злокачественное новообразование или тромбоз в анамнезе). Таким образом, к одной группе могут быть отнесены операции на печени, кишечнике, органах мочевыводящей системы, т.е. совершенно не учитывается, что различные органы и ткани могут выделять вещества, способные по-разному влиять на гемостаз. В проведенных ранее исследованиях было показано, что органы мочевыделительной системы могут оказывать прямое влияние и на фибринолитическую систему вследствие выделения урокиназного активатора плазминогена [8]. Следствием развития гиперфибринолиза могут явиться геморрагические осложнения [9,10].
В настоящее время существенной проблемой является информативность тестов, характеризующих свертывающую и фибринолитическую систему. Рутинно используемые в каждодневной практике так называемые «скрининговые» тесты направлены на диагностику гипокоагуляции, в то время как к активации свертывания и усилению образования тромбина они не чувствительны [11]. Одним из наиболее современных методов для оценки активации системы гемостаза in vivo является определение пептидов, отделяющихся от основных белков свертывающей и фибринолитической систем крови при их активации, а также количественное определение белков свертывающей системы и их комплексов [12].
Целью нашего исследования стало изучение интраоперационных сдвигов в системе гемостаза при трансуретральной резекции предстательной железы и составление схем коррекции возникших нарушений.
Материал и методы. В проспективное исследование было включено 60 мужчин с верифицированным раком предстательной железы и признаками отдаленного метастазирования, не имевших тромботических осложнений в анамнезе, трансуретральная резекция (ТУР) предстательной железы которым выполнялась как паллиативная операция для восстановления оттока мочи. Операция проводилась в условиях спинномозговой анестезии бупивакаином 15-20 мг без седации пациента.
Общими критериями включения в исследование явились следующие признаки: отсутствие локализованного и системного воспалительного процесса, сахарного диабета, отсутствие приема препаратов, влияющих на свертывающую систему крови.
Контрольную группу составили 20 человек. На основании результатов, полученных в этой группе, производилась оценка показателей системы гемостаза в периоперационном периоде, определялись возможные пути коррекции выявленных нарушений. В исследуемую группу были включены 40 пациентов, которым в ходе оперативного вмешательства производилась коррекция гемостаза.
Общая характеристика пациентов, включенных в исследование, представлена в табл. 1. Из-за небольшого числа участников исследования добиться сопоставимости групп не удалось. Тем не менее, статистически значимых различий по возрасту, продолжительности вмешательства, сопутствующим заболеваниям между группами не было.
Статистическая обработка результатов произведена с использованием программного обеспечения Statistica 7. Для сравнения показателей между группами применялся U-критерий Манна-Уитни, для оценки внутригрупповых изменений использовался критерий Ньюмена-Кейсла. Для сравнения дискретных переменных применяли критерий Пирсона (χ2). Полученные данные представлены в виде медианы (Ме), 25 и 75 процентилей (P25 и P75).
Таблица 1. Характеристика больных, включенных в исследование (медиана, 25 и 75 процентили) Мe (P25-P75)
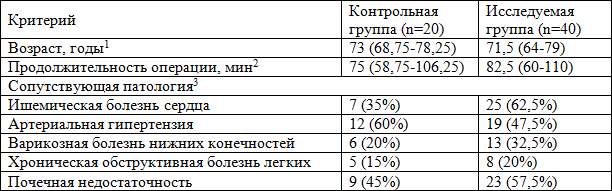
Примечания: 1 - критерий U Манна-Уитни Uэмпир.=358, Uкрит.=251, p<0,01, различия недостоверны; 2 – критерий U Манна-Уитни Uэмпир.=359,5, Uкрит.=251, p<0,01, различия недостоверны; 3 - χ2=2,567; число степеней свободы ν=4; при p=0,001 χ2крит.=18,467, различия недостоверны
Забор материала производился непосредственно перед разрезом кожи (I этап), в момент хирургического воздействия на ткань предстательной железы (II этап) и сразу после ушивания раны кожи (III этап). Кровь набиралась из локтевой вены без жгута с использованием одноразовых вакуумных пробирок Vacuette с натрия цитратом 3,2%, соотношение крови и антикоагулянта 1:9. Скрининговые показатели: активированное парциальное тромбиновое время (АПТВ), протромбиновое время (ПВ), уровень фибриногена по Clauss определялись на автоматическом анализаторе гемостаза ACL 7000, Instrumentation Laboratory, USA.
Образцы крови для исследования методом иммуно-ферментного анализа (ИФА) центрифугировались на бакетном роторе с охлаждением со скоростью 3000 оборотов в мин. в течение 30 мин. Плазма отделялась, разливалась по пробиркам Eppendorf и замораживалась в течение 30 мин. после забора крови. Хранение образцов производилось при температуре -45ºС.
Методом ИФА определяли содержание комплексов тромбин-антитромбин (ТАТ) (набор реактивов AssayMaxHuman Thrombin-antithrombin Complexes ELISA, AssayPro, США), диапазон нормальных значений по данным литературы составляет 1,0-4,1 нг/мл, плазмин-антиплазмин (ПАП) (PAP Complex ELISA, Technoclone, Vienna, Austria) в норме 0-514 нг/мл, D-димеров (TECHNOZYM®D-Dimer ELISE, Technoclone, Vienna, Austria), нормальные уровень 0-250 нг/мл, урокиназного активатора плазминогена (u-PA) (Technoclone, Vienna, Austria), физиологические показатели 0,2-0,33 нг/мл.
Пациентам исследуемой группы во время операции в/в на 200,0 мл 0,9% раствора хлорида натрия вводилась транексамовая кислота в дозе 1 г. Полученные результаты представлены в табл. 2.
Результаты. Отсутствие достоверных различий в «скрининговых» показателях в полученных данных подтверждает их нечувствительность, а, следовательно, неинформативность в диагностике гиперкоагуляции и патологии фибринолиза [11].
Исследование концентрации урокиназного активатора плазминогена производилось только в контрольной группе и имело целью определение наличия или отсутствия выброса активатора фибринолиза во время манипуляций на предстательной железе.
ТАТ комплекс является маркером активации системы гемостаза [12,14] и представляет собой продукт взаимодействия тромбина и антитромбина III. Это неактивный комплекс, который удаляется из системы циркуляции печенью в течение нескольких минут после формирования. Поэтому увеличение ТАТ в системе циркуляции прямо свидетельствует о развитии гиперкоагуляции с увеличением образования тромбина и истощении антикоагулянтов в момент взятия крови [15]. Повышенный уровень комплекса ТАТ в нашем исследовании свидетельствует об активации свертывающей системы крови даже на I этапе, вероятно, в ответ на наличие в организме пациентов злокачественного процесса и сопутствующей патологии. Статистически значимое увеличение его концентрации на II и III этапах свидетельствует об усилении коагуляционного потенциала во время оперативного вмешательства. Пациентам исследуемой группы, тем не менее, фармакологическая тромбопрофилактика в предоперационном периоде не проводилась. Это связано с имеющимися в литературе данными, свидетельствующими об увеличении частоты геморрагических осложнений при использовании антикоагулянтов [16].
Исследование фибринолитической системы мы проводили, определяя уровень комплекса плазмин-α2-антиплазмин. Этот неактивный комплекс образуется при ингибировании плазмина путем связывания его с α2-антиплазмином [15].
Таблица 2. Показатели системы свертывания крови у больных, включенных в исследование Мe (P25-P75)
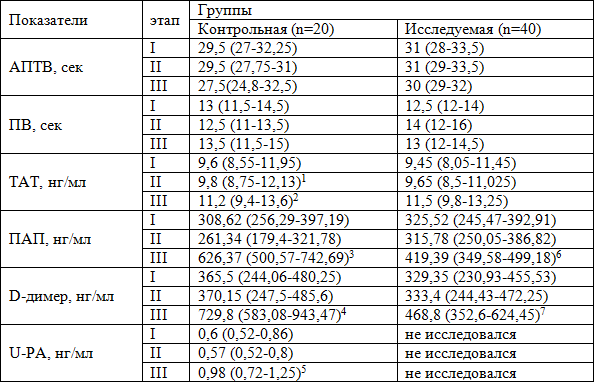
Примечания: 1 - критерий Ньюмена-Кейсла при сравнении с I этапом, qэмпир.=4,47, qкрит.=4,12 при уровне значимости α=0,01 различия достоверны; 2 - критерий Ньюмена-Кейсла при сравнении со II этапом, qэмпир.=4,47, qкрит.=4,12 при уровне значимости α=0,01 различия достоверны; 3- критерий Ньюмена-Кейсла при сравнении со II этапом, qэмпир.=5,8, qкрит.=4,12 при уровне значимости α=0,01 различия достоверны; 4- критерий Ньюмена-Кейсла при сравнении со II этапом, qэмпир.=5,37, qкрит.=4,12 при уровне значимости α=0,01 различия достоверны; 5 - критерий Ньюмена-Кейсла при сравнении со II этапом, qэмпир.=5,8, qкрит.=4,12 при уровне значимости α=0,01 различия достоверны; 6 - критерий U Манна-Уитни при сравнении с аналогичным этапом контрольной группы, Uэмпир.=210, Uкрит.=251, различия значимы, p≤0,01; 7 - критерий U Манна-Уитни при сравнении с аналогичным этапом контрольной группы, Uэмпир.=140,5, Uкрит.=251, различия значимы, p≤0,01
Значения концентраций комплекса ПАП в обеих группах были примерно одинаковыми и находились в пределах нормальных значений (по данным инструкции по лабораторному определению показателя) в пред- и интраоперационном периодах. Стоит отметить, что проведенные ранее исследования показали, что концентрации этого комплекса у данной категории пациентов превышают аналогичные показатели у практически здоровых лиц. Это может свидетельствовать как о наличии реактивного (вторичного, в ответ на гиперкоагуляцию), так и первичного усиления фибринолиза. О наличии последнего свидетельствует повышенный исходный уровень урокиназного активатора плазминогена. Резкое увеличение комплекса ПАП в послеоперационном периоде, скорее всего, объясняется выбросом u-PA, уровень которого достоверно повышался в послеоперационном периоде. Механизм поступления фермента в кровь нам представляется следующим. Ход операции ТУР предстательной железы подразумевает длительное воздействие непосредственно на опухолевую ткань с вероятным постоянным контактом зияющих кровеносных сосудов с разрушенной железой и возможным поступлением в кровь выделяющегося из злокачественных клеток урокиназным активатором плазминогена.
Уровень D-димера, представляющего собой продукт лизиса плазмином поперечно сшитого фибрина, и соответственно являющегося показателем, отражающим состояние как коагуляционного, так и фибринолитического звена [14], в исследуемой группе был ниже на III этапе исследования, что свидетельствует о более компенсированном состоянии системы гемостаза на фоне предложенной схемы лечения.
Выводы
1. У пациентов с метастатическим раком предстательной железы имеет место повышение потенциала свертывающей системы крови. Это обусловлено как распространенностью процесса, так и наличием сопутствующих заболеваний.
2. Фибринолитическая система активирована как вторично (ответ на повышенное тромбообразование), так и первично (повышенный уровень u-PA).
3. Во время ТУР предстательной железы происходит закономерное усиление коагуляционного потенциала.
4. Операция сопровождается выбросом урокиназного активатора плазминогена, приводящего к резкой активации фибринолиза.
5. Для снижения активности фибринолитической системы целесообразно интраоперационное введение транексамовой кислоты.
