Рак предстательной железы (РПЖ) является второй наиболее часто диагностируемой злокачественной опухолью и шестой по значимости причиной смерти от онкопатологии у мужчин в мире, что составило в 2008 году 14% от всех новых случаев рака и 6% от всех случаев смерти от рака у мужчин [1]. Удельный вес РПЖ в структуре онкологической заболеваемости мужского населения России увеличился с 1,5% в 1998 г. до 5,17% в 2010 г. и занял 4-е место после злокачественных новообразований органов дыхания, желудка, кожи [2,3]. РПЖ занимает 3-е место (6,2%) в структуре смертности мужского населения России после рака легкого и желудка [2].
В последнее десятилетие наметилась тенденция к увеличению частоты распространения рака предстательной железы у мужчин сравнительно молодого и работоспособного возраста [4,5], что, в свою очередь, приводит к росту смертности в этой группе населения.
Учитывая вышесказанное, актуальность диагностики ранних, локализованных форм РПЖ не вызывает сомнений. Часто выявляемые случаи бессимптомного течения РПЖ, особенно на ранних стадиях, требуют поиска скрининговых подходов к методам его раннего выявления.
Скрининг рака простаты имеет кардинальные отличия от скрининга злокачественных заболеваний других локализаций, так как в ходе его диагностируются и другие заболевания предстательной железы (доброкачественная гиперплазия предстательной железы, простатит), что позволяет проводить правильную и своевременную терапию.
Скрининг РПЖ проводят на основании определения уровня простатспецифического антигена (ПСА) в сыворотке и пальцевого ректального исследования (ПРИ).
Определение содержания ПСА. Диагностика РПЖ кардинально улучшилась с введением анализа сыворотки крови на уровень ПСА [6].
Основные формы ПСА в сыворотке крови, обнаруженные на основе иммунологического анализа, следующие:
- свободные формы ПСА – 5-55% общего ПСА;
- комплексные (связанные) формы:
- ПСА-а1-антихимотрипсин (ПСА-АХТ) – 60-95% общего ПСА);
- ПСА-а1-макроглобулин (ПСА-МГ) – 1-2% общего ПСА.
Уровень ПСА является непрерывным параметром, т.е. чем выше его значение, тем больше вероятность наличия РПЖ (табл.1). Недавнее исследование по профилактике РПЖ, проведенное в США, подтвердило данные о том, что у многих мужчин РПЖ может присутствовать, несмотря на низкий уровень ПСА в сыворотке крови [7].
Таблица 1. Риск РПЖ при низком уровне ПСА
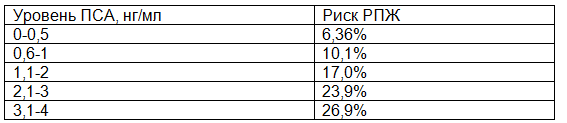
До настоящего момента не получено данных, на основании которых можно было бы определить оптимальное пороговое значение ПСА для выявления непальпируемого, но клинически значимого РПЖ.
Широкое распространение исследования на ПСА привело к повышению количества выполняемых биопсий предстательной железы в США до миллиона в год. Однако, уровень ПСА в сыворотке не является специфичным для рака простаты. Таким образом, из примерно 4 мужчин с повышенным уровнем ПСА, подвергающихся биопсии простаты только у одного действительно будет выявлено заболевание. Более того, у некоторых мужчин при наличии злокачественного процесса в предстательной железе уровень ПСА остается в пределах нормальных цифр и, таким образом рак остается невыявленным. Было предложено использовать некоторые модификации значения ПСА в сыворотке, которые могут повысить специфичность этого показателя для ранней диагностики РПЖ, а именно: возрастные нормы, плотность ПСА, плотность ПСА переходной зоны, скорость ПСА, время удвоения ПСА и его молекулярные формы.
Развитие молекулярной диагностики предоставило перспективы для специфического тестирования рака простаты. Это генетическое исследование мочи на ПСА-3, ген, кодирующий участок мРНК, расположенный в 9-й хромосоме, гиперэкспрессирован в клетках рака простаты в сравнении со всеми остальными клетками. Согласно международным исследованиям, при сравнении сывороточных уровней ПСА и уровня ПСA-3 в моче, последний оказался более специфичным для рака простаты.
Начальные исследования свидетельствуют, что этот новый маркер обладает гораздо большей специфичностью, чем тест на ПСА. В отличие от сывороточных маркеров ПСА-3 измеряется в осадке мочи, полученной после массажа предстательной железы. Преимуществом ПСА-3 является его несколько более высокая чувствительность и специфичность по сравнению с ПСА. ПСА-3 отражает небольшие, но значимые увеличения показателя при положительном результате биопсии [8], однако не зависит от объема предстательной железы или наличия простатита [9]. Информация о том, связан ли уровень ПСА-3 с агрессивностью опухоли, противоречива. Хотя этот показатель потенциально имеет прогностическую ценность для выявления РПЖ у мужчин с повышенным уровнем ПСА, у которых первичная биопсия, тем не менее, показала отрицательный результат, метод определения ПСА-3 остается экспериментальным.
Среди новых биомаркеров РПЖ:
- Простатический специфический мембранный антиген (PSMA) увеличивается при метастатическом раке, особенно, при резистентности к гормонам. Считается, что PSMA в большей степени, чем ПСА характеризует скрытое клиническое прогрессирование [10].
2) Хромогранин А – потенциальный опухолевый маркер, выделяется секреторными гранулами нейроэндокринных клеток. Выделение этого маркера предсказывает плохой прогноз [11].
- Антиген простатических стволовых клеток (PSСA) – выявляется при метастатическом РПЖ, инвазии семенных пузырьков и капсулы простаты, используется как мишень для моноклональных антител [12].
В ближайшем будущем несколько молекулярных диагностических анализов, возможно, будут использоваться не только в лабораториях, но и в клинической практике, например, для обнаружения гибридных генов TMPRSS2-erg, специфических для РПЖ, в осадке мочи после массажа [13, 14].
На данном этапе ни один из перечисленных биомаркеров не используется в клинической практике в качестве основания для назначения пациентам проведения биопсии предстательной железы с целью исключить РПЖ.
Пальцевое ректальное исследование (ПРИ). В диагностике заболеваний предстательной железы особое внимание уделяется ПРИ. В ситуациях, когда уровень простатспецифического антигена остаётся в пределах нормы, этот метод позволяет выявить рак предстательной железы и предположить стадию заболевания [15]. Большинство новообразований предстательной железы локализуются в периферической зоне предстательной железы и могут быть выявлены при ПРИ, если их объем достигает 0,2 мл и более.
Пальцевое исследование прямой кишки – самый простой, дешевый и безопасный метод обследования в диагностике заболеваний предстательной железы, в том числе и рака. Более того, ПРИ остается обязательным методом не только для диагностики, но и для дифференциальной диагностики ряда заболеваний простаты, в том числе доброкачественной гиперплазии простаты, ее острых и хронических инфекционно-воспалительных заболеваний. В среднем, только у одной трети пациентов с наличием пальпируемых участков, подозрительных на рак предстательной железы, впоследствии морфологически верифицируют злокачественную опухоль простаты [15].
К недостаткам метода относится и частая невозможность оценки стадии рака предстательной железы, поскольку небольшие опухоли, расположенные в передних отделах железы, как правило, не пальпируются. И не всегда размеры простаты, определяемые при пальцевом ректальном исследовании, соответствуют истинным размерам доброкачественной гиперплазии простаты [16].
Выявление подозрительных уплотнений с помощью ПРИ является абсолютным показанием для проведения биопсии предстательной железы. Примерно, у 18% всех больных РПЖ выявляется только по подозрительным участкам при ПРИ независимо от уровня ПСА [17]. Выявление подозрительных участков при ПРИ у больных с уровнем ПСА < 2 нг/мл имеет положительную прогностическую ценность в 5-30% [18]. Однако, по данным Б.П. Матвеева и соавт. (1999), используя только ПРИ, можно выявить РПЖ в 5,6% [5].
Скрининг рака предстательной железы является противоречивым вопросом современной медицины в общем, и в урологической практике в частности [19]. Достоинства введения национальных программ скрининга рака простаты в Европе в настоящее время находятся в центре обсуждения. Пока подход к скринингу рака предстательной железы в разных Западных странах отличается. В США отношение к скринингу рака предстательной железы наиболее благоприятное. Американское сообщество по изучению рака рекомендует выполнение скрининга рака предстательной железы для всех мужчин в возрасте старше 50 лет. Между тем, все мужчины должны быть ориентированы в вопросах, связанных с возможными последствиями ранней диагностики и лечения рака предстательной железы, и поэтому принятие решения об участии в скрининге является совместным с врачом. Неоспоримые доказательства того, что скрининг по уровню ПСА снижает смертность от РПЖ, до сих пор не представлены [20].
В 2009 г. были опубликованы долгожданные результаты 2 проспективных рандомизированных исследований. В ходе скринингового исследования рака предстательной железы, легкого, яичников и колоректального рака (Prostate, Lung, Colorectal and Ovarian – PLCO) 76 693 пациента в 10 исследовательских центрах США были рандомизированы в группу прохождения ежегодного ПСА-скрининга и ПРИ или в группу обычного лечения (в качестве контрольной). По результатам 7-летнего последующего наблюдения показатель заболеваемости РПЖ на 10 000 человеко-лет составил 116 (2820 случаев рака) в скрининговой группе и 95 (2322 случаев рака) – в контрольной группе [21]. Показатель смертности на 10 000 человеко-лет составил 2 (50 летальных исходов) в скрининговой группе и 1,7 (44 летальных исхода) в контрольной группе. Данные после 10 лет наблюдения были обработаны на 67% и коррелировали с этими общими результатами. Исследовательская группа проекта PLCO пришла к выводу, что смертность от РПЖ очень низка и лишь незначительно различается между 2 группами. Европейское рандомизированное исследование РПЖ (European Randomized Study of Screening for Prostate Cancer – ERSPC) включало 162 243 мужчин из 7 стран в возрасте от 55 до 69 лет. Мужчин рандомизированно распределяли в группу для прохождения ПСА-скрининга (в среднем 1 раз в 4 года) или в контрольную группу, не подвергавшуюся скринингу. При 9-летней медиане наблюдения кумулятивная заболеваемость РПЖ составила 8,0% в экспериментальной группе и 4,8% - контрольной группе [22]. Соотношение уровней смертности от РПЖ в экспериментальной группе по сравнению с контрольной составило 0,8. Разность абсолютных рисков составила 0,71 летальных исходов на 1000 мужчин. Это означает, что для предотвращения 1 смерти от РПЖ необходимо провести скрининг 1410 пациентов и лечение 48 дополнительных случаев РПЖ. Исследователи ERSPC пришли к выводу, что ПСА-скрининг снизил уровень смертности на 20%, но был связан с высоким риском гипердиагностики. Оба исследования привлекли большое внимание и вызвали дискуссии. В исследовании PLCO уровень доказательности в экспериментальной группе составил 85% для ПСА и 86% для ПРИ. Однако, показатель заболеваемости РПЖ в экспериментальной группе достиг 40% за первый год и вырос до 52% на 6-й год для ПСА, а в подгруппе ПРИ варьировал от 41 до 46%. Более того, достоверность результатов при проведении биопсии была лишь 40-52%, тогда как в исследовании ERSPC – 86%. Таким образом, исследование PLCO, вероятно, так и не сможет ответить на вопрос о том, влияет ли ПСА-скрининг на смертность от РПЖ. В исследовании ERSPC эффективность применения скрининга можно будет по-настоящему оценить через 10-15 лет последующего наблюдения. Основываясь на результатах этих 2 крупных рандомизированых исследований, подавляющее большинство урологических сообществ пришли к заключению, что в настоящее время широкое использование массового ПСА-скрининга не целесообразно. Вместо этого следует использовать раннюю диагностику (внеплановое обследование) в сочетании с информированием мужского населения.
Предлагается проводить исходное определение уровня ПСА в возрасте 40 лет, на основе которого можно установить частоту обследований [23]. Для мужчин с начальным уровнем ПСА < 1 нг/мл представляется достаточным 8-летний интервал между обследованиями [24]. Мужчинам старше 75 лет с исходным уровнем ПСА < 3 нг/мл нет необходимости проходить дальнейшее ПСА-тестирование, поскольку риск смерти от РПЖ у этой группы очень низкий [24].
Отсутствие в Российской Федерации государственной программы скрининга РПЖ ставит перед каждым регионом задачу самостоятельного решения данной проблемы. Опыт прошлых лет показывает, что мероприятия по ранней диагностики эффективны, если они проводятся в условиях диспансеризации. Комплексное обследование пациентов диспансерной группы с применением ПСА, ПРИ, трансректального ультразвукового исследования и других методов дает основную надежду на раннее выявление РПЖ. Основой диспансеризации является формирование групп повышенного онкологического риска, активное обследование пациентов данных групп с целью раннего выявления РПЖ, что является непременным условием улучшения результатов лечения и снижения смертности от данной патологии.
