Введение. По расчётным данным, в 2009 г. в Российской Федерации абсолютное число больных с впервые в жизни установленным диагнозом рака мочевого пузыря (РМП) составило 12328 человек, что соответствует в среднем ежедневной регистрации 34 случаев. Причём среднегодовой темп прироста составляет 0,92% [6,7].
В современной международной классификации по системе ТNМ различают мышечно-неинвазивный рак мочевого пузыря (сюда относят Та, Тis , Т1) и мышечно-инвазивный (Т2-4). Данные две категории отличаются по клиническому течению и лечебной тактике [15].
Сравнительно не давно начал применяться термин местно-распространённого РМП, к которому относят мышечно-инвазивный рак в стадиях Т3-4a N0-3 М0 [15]. Что соответствует III и IV клинической стадии опухолевого процесса, когда локализация опухоли и (или) площадь поражения не позволяют выполнить органосохраняющую операцию. Порядка 70% больных раком мочевого пузыря страдают мышечно-неинвазивным, а 30% и более – мышечно-инвазивным РМП. В этих случаях всегда возникает необходимость радикальной цистэктомии (ЦЭ) и пластического замещения мочевого пузыря.
Рекомендациями европейского общества урологов от 2011 года при ЦЭ являются: стадия заболевания T2-4аN0M0 с высоким риском прогрессирования; отсутствие предоперационной лучевой терапии; лимфаденэктомия с 2-х сторон, объем которой определяет оперирующий хирург; при сохранении уретры проводить регулярные уретроскопии; роботизированная и лапароскопическая оперативные доступы являются опцией; пациент должен быть информирован обо всех возможных методах лечения возможных при его диагнозе и стадии; ортотопическая пластика производится при отсутствии каких-либо противопоказаний к ней и отсутствии поражения опухолью мочеиспускательного канала и на уровне резекции её и ниже [1,3,18].
Причем у 40-85% больных мышечно-инвазивным РМП имеются микрометастазы в регионарных лимфатических узлах, что предполагает необходимость воздействия на всю слизистую и возможные метастазы. Этого можно достичь применением комбинированного и комплексного лечения с использованием хирургического, лучевого и химиотерапевтического компонентов [3,8].
Отечественные и мировые данные свидетельствуют о преимуществах сочетания хирургического метода лечения с неоадъювантной (НАХТ) и/или адъювантной (АХТ) системной полихимиотерапией (ПХТ).
Показания для использования НАХТ основываются на клинической стадии заболевания. Основными задачами НАХТ являются: уменьшение объема опухоли; воздействие на микрометастазы, не определяемые клинически в период постановки диагноза; повышение абластичности операции и резектабельности опухоли. Следует подчеркнуть, что чем меньше размер микрометастазов, тем больше шансов достигнуть их полного исчезновения. Использование химиотерапии до хирургического лечения предпочтительнее, так как поступление лекарственных препаратов к первичному очагу и зонам метастазирования будет лучше вследствие сохранения естественных путей крово- и лимфотока [1,2,4,5,12-16,18,19].
Проведен ряд исследований по изучению эффективности НАХТ у больных РМП. Норвежские исследователи использовали 2 цикла цисплатина и адриамицина в неоадьювантном режиме. Анализ выживаемости показал преимущество в 15% у больных в стадии Т3а-Т4а [19].
Химиотерапия в неоадьювантном режиме снижает глубину инвазии опухоли, повышает радикализм операции. Однако представленные данные показывают, что в подавляющем большинстве случаев не удалось значительно повысить выживаемость пациентов, но значительно увеличился безрецидивный период, что отразилось на улучшении качества жизни данной группы пациентов [11-13,16,18,19].
Назначение АХТ основано на данных патологоанатомического исследования, результатах хирургического вмешательства (радикальность операции) и прогностических факторах течения заболевания. АХТ может выполняться немедленно или отсрочено после оперативного лечения. Целесообразность ее выполнения определяется предполагаемым прогнозом течения заболевания, основанном на факторах риска, когда ожидается дальнейшее прогрессирование заболевания или развитие местного рецидива.
Наибольшее ее преимущество в том, что она проводится после патологоанатомического исследования, и клиницист располагает наиболее достоверными и объективными данными о распространении опухолевого процесса в мочевом пузыре и состоянии регионарных лимфатических узлов.
Проведен ряд рандомизированных исследований по эффективности АХТ у больных мышечно-инвазивным РМП. Сравнительное исследование проведено у 91 больного после ЦЭ в стадии рТ3-4 или N+ с использованием в качестве адьюванта циклофосфана, адриабластина и цисплатина. В другой группе проведено наблюдение за больными. Отмечено значительное увеличение времени до прогрессирования у пациентов, где выполнено АХТ. Безрецидивная выживаемость в течение 3 лет составила 70% по сравнению с 46%, где дополнительной терапии не проводилось (р=0,01). Выявлено значительное увеличение выживаемости до 4,3 лет по сравнению с 2,4 в контрольной группе (р=0,0062) [13].
Рандомизированные исследования показали, что адъювантная химиотерапия может удлинить безрецидивный период заболевания, однако не позволяет существенно увеличить продолжительность жизни.
В одном из исследований последних лет были оценены результаты двух лечебных подходов у больных, подвергшихся цистэктомии при местно-распространенном РМП. Одна группа больных получала как НАХТ так и АХТ; вторая группа больных получала только АХТ. При медиане наблюдения за больными 6,8 года 58% больных не имели рецидива заболевания. Хотя статистически достоверной разницы между обеими группами получено не было, эти данные значительно превзошли результаты лечения аналогичной группы больных, перенесших только цистэктомию, где лишь 30% больных не имели рецидива заболевания. Этим исследованием была подтверждена роль системной химиотерапии в лечении местно-распространенного РМП [13,16,18,19].
До последнего времени возможности химиотерапии РМП были весьма ограничены. На протяжении последних 15 лет традиционно применяемой схемой являлась M-VAC [метотрексат, винбластин, доксорубицин (фарморубицин), цисплатин], отнесенная к «золотому стандарту» лечения, эффективность которой составляет в среднем 50% у больных с генерализованными формами заболевания. Медиана продолжительности жизни при этом равна 12,5 мес. даже при достижении полной ремиссии. Однако это достаточно токсичная схема, приводящая к развитию более чем у 85% больных побочных реакций и осложнений (III и IV степени) [1-3,5,9,11].
В 2005 году был опубликован мета-анализ основанный на изучении 11 международных исследований, на 3005 пациентах с применением препаратов платины в неоадьювантном режиме. Результаты подтверждают увеличение общей 5-летней выживаемости в 5% случаев и безрецидивной выживаемости в 9% [18].
В МНИОИ им. П.А. Герцена предложена технология НАХТ инвазивного РМП с использованием нового режима введения гемцитабина и производных платины. Больные, ответившие на проведение НАХТ, после операции получили еще 3 курса АХТ по прежней схеме. Таким образом, всем больным удалось выполнить органосохраняющую или органозамещающую операцию. Объективный ответ на проведенное лечение отмечен у 21 (44,7%) больного. Дополнительно у 19 (40,4%) больных получена стабилизация процесса [4].
По эффективности системной полихимиотерапии на данный момент проводятся многоцентровые рандомизированные исследования по консолидации опыта различных стран мира. Тем не менее последние годы в исследованиях всё больше уделяется внимание группе пациентов получивших комбинированное лечение местно-распротраненного рака мочевого пузыря в объеме неоадьювантной полихимиотерапии, радикальной цистэктомии и адьювантной полихимиотерапии. У данной категории больных наблюдаются лучшие показатели выживаемости и эффективности системной полихимиотерапии, при этом сохраняется относительно высокое качество жизни.
Цель исследования: увеличить продолжительность жизни больных местно-распространенным раком мочевого пузыря.
Материалы и методы. Под наблюдением в ФГУ «НИИ урологии» Минздравсоцразвития РФ с 2001 по 2011 годы находилось 69 пациентов с местно-распространенным РМП, средний возраст 60,8±0,5 лет. Стадии заболевания: от T3бN0M0 до T4аN3M0 (согласно Международной классификации TNM онкологических заболеваний, 2009 год). У всех пациентов выявлен переходно-клеточный рак 2 или 3 степеней дифференцировки. У 20 больных выявлена инфильтрация паравезикальной клетчатки, без признаков отдаленного и регионарного метастазирования, у 32 больных инфильтрация паравезикальной клетчатки при наличии увеличения регионарных лимфатических узлов и у 17 пациентов инвазия в предстательную железу при наличии увеличения регионарных лимфатических узлов. Всем пациентам выполнена радикальная цистэктомия (ЦЭ) с различными видами деривации мочи: 38 пациентам – наложение илеум кондуита (по Брикеру), 24 пациентам – ортотопическая пластика мочевого пузыря по Штудеру и 7 пациентам произведено формирование гетеротопического мочевого резервуара. 52 больным проведена системная химиотерапия по схеме GP, 12 по схеме M-VAC, 5 по схеме CMV. НАХТ назначена 40 больным. После получения результатов гистологического исследования 50 пациентам назначена АХТ. Таким образом, пациенты распределены согласно режиму системной ПХТ следующим образом: НАХТ+ЦЭ–27 (20,5%), ЦЭ+АХТ – 21 (15,9%), НАХТ+ЦЭ+АХТ – 21 (15,9%), ЦЭ (контрольная группа) – 63 (47,7%) пациента.
Оценка результатов лечения проводилась согласно “Новым предложениям Всемирной Организации Здравоохранения (ВОЗ) по стандартизации оценки результатов лечения онкологических больных”. Общее состояние больного оценивали по шкале Карновского и ECOG-BОЗ (Eastern Cooperative Oncology Group). Критериями токсичности выбраны гематологические показатели, которые оценивались по шкале NCIC-CTC.
При изучении выживаемости больных использовался интервальный метод построения таблиц дожития по Kaplan & Meier. Все расчеты производились с применением программ Statistica 6,0 и 7,0 (StatSoft,USA).
Результаты. При оценке выживаемости системной ПХТ нами проведено сравнение групп наблюдения, представленное на рис. 1.
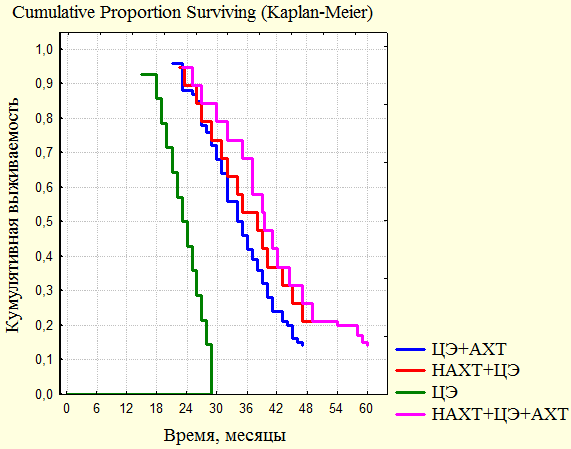
Рис. 1. Общая 3-летняя выживаемость пациентов различных групп после полученного лечения.
При оценке выживаемости в группе НАХТ 21% больных прожили более 4 лет, но не пережили 5-летний рубеж. В группе, ЦЭ+АХТ удалось достичь только показателя 3-летней выживаемости, который составил 43%. В группе ЦЭ - никто из больных не дожил до 3 лет, при этом 2-летняя выживаемость составила 30%. В группе АХТ+НХТ+ЦЭ 3 пациента (15%) живы на данный момент, прошли 5-летний порог выживаемости, нет признаков прогрессирования опухолевого процесса.
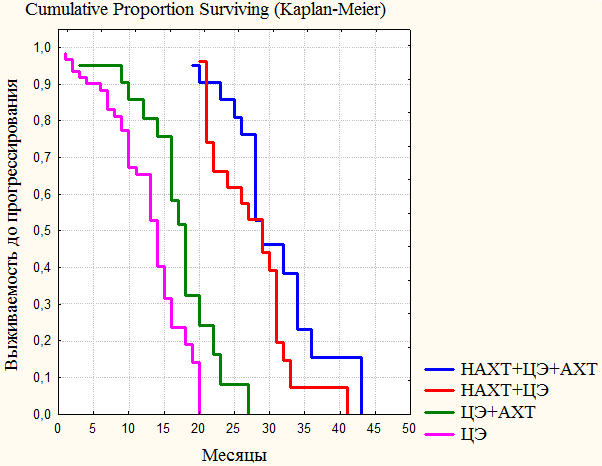
Рис. 2. Выживаемость до прогрессирования пациентов различных групп.
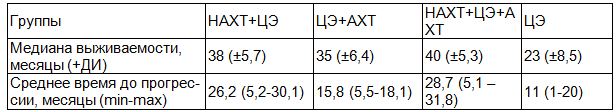
Медиана выживаемости и среднее время до прогрессирования представленные в табл. 1 убедительно доказывают превалирование режима НАХТ+ЦЭ+АХТ над остальными.
Таблица 1.Выживаемость различных групп после комбинированного лечения
Качество жизни пациентов после полученного лечения в среднем в группе НАХТ+ЦЭ составило 1,5 (1-15,2-10,3-2), в группе НАХТ+ЦЭ +АХТ составило 1,6 (1-11,2-8,3-2), в группе ЦЭ+АХТ составило 1,4 (1-13,2-7,3-1). В то время как в контрольной группе ЦЭ данный показатель составил 2,1 (1-38,2-10,3-12, 4-3) (χ2=23,359, р=0,000) (в скобках указано количество пациентов получивших соответствующий бал по шкале ECOG).
Таблица 2. Клиническая эффективность, гематологическая токсичность и качество жизни больных после системной полихимиотерапии в различных режимах
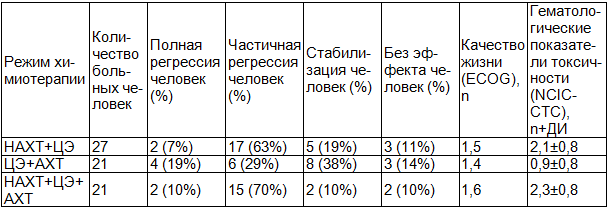
Обсуждение результатов. Таким образом, эффективность НАХТ+ЦЭ+АХТ больше на 5% чем при НАХТ+ЦЭ, на 12,5% чем при ЦЭ+АХТ и на 42,5% чем при ЦЭ. Клиническая эффективность системной полихимиотерапии в различных режимах подтверждает наиболее высокие показатели при режиме НАХТ+ЦЭ+АХТ. При этом, различия групп больных по качеству жизни статистически не значимо (χ2=23,359, р=0,000).
При оценке показателей выживаемости до прогрессирования нами получены статистически и клинически значимое увеличение времени до прогрессирования в группе пациентов НАХТ+ЦЭ (26,2 месяца) и ещё лучший результат в группе НАХТ+ЦЭ+АХТ (28,7 месяца). Таким образом, увеличение продолжительности времени жизни пациентов с местно-распространенным раком мочевого пузыря без признаков прогрессирования в 2,4 раза отмечено при использовании системной ПХТ в неоадьювантном режиме и в 2,6 раза отмечено при использовании системной полихимиотерапии в неоадьювантном и адьювантном режиме (таблица 1). В группе ЦЭ+АХТ данный показатель выше контрольной группы в 1,4 раза (15,8 месяца). Почему же общая выживаемость отличается незначительно, а время до прогрессирования приближается к группе ЦЭ. Это связано с тем, что назначение системной ПХТ после операции проводилось при прогрессировании, либо при интраоперационном определении более высокой стадии распространенности опухолевого процесса, что существенно уменьшило среднее время до прогрессирования. Это подтверждается и данными зарубежных исследователей.
После системной ПХТ в различных режимах качество жизни больных, не отличается друг от друга и переносимость химиотерапии не зависит от режима проведения химиотерапии. Токсичность различных режимов системной ПХТ значимо влияет на летальность и клиническую эффективность химиотерапии и чем выше токсичность, тем больше продолжительность жизни больного и клиническая эффективность ПХТ.
Комбинированное лечение местно-распространенного рака мочевого пузыря значимо улучшает показатели выживаемости, что особенно важно для людей работоспособного возраста. Своевременная диагностика и комбинированное лечение местно-распространенного рака мочевого пузыря позволяют добиться лучших показателей общей и безрецидивной выживаемости, что в итоге повышает суммарный эффект проводимого лечения и способствует сохранению, а в некоторых случаях и повышению качества жизни пациентов.
Выводы
- При комбинированном лечении местно-распространенного рака мочевого пузыря медиана выживаемости составила 37,5 месяца, а среднее время до прогрессирования 24,5 месяца, что на 14,5 и 13,5 месяца больше, чем в группе исключительно цистэктомии.
- Эффективность неоадьювантной системной полихимиотерапии, определяемой по таким показателям как полная или частичная регрессия, а также стабилизация первичной опухоли, в значительной мере зависит от степени её распространенности.
- Подтвержденный инструментально клинический эффект, либо стабилизация опухолевого процесса после неоадъювантной полихимиотерапии, должен быть закреплен адъювантной полихимотерапией после радикальной цистэктомии.
