Введение. Стриктура мочеточника – это врожденное или приобретенное соединительнотканное перерождение стенки мочеточника, уменьшающее его просвет [2]. Развитие этой патологии происходит зачастую без ярких манифестных проявлений, однако длительное существование, приводит к характерной клинической картине и прогрессирующему вторичному снижению функции почки. Наиболее частыми этиологическими факторами стриктурообразования является хронический воспалительный процесс верхних мочевыводящих путей (ВМП) в сочетании с мочекаменной болезнью (МКБ), однако не редки и другие причины: ятрогенное повреждение мочеточника, врожденная аномалия, вовлечение в опухолевый процесс окружающих тканей.
С гистологической точки зрения, любая стриктура представляет собой пролиферацию фибробластов, стремящихся «закрыть» скомпрометированную различными факторами агрессии нормальную слизистую оболочку мочеточника. Опасность для уротелия может исходить как извне, так и изнутри органа. Так, интраоперационное пересечение мелких артерий, осуществляющих питание стенки мочеточника, неизбежно приводит к ишемизации участка органа и компенсаторному разрастанию фибробластов, как клеток, наиболее устойчивых к гипоксии. Ранение слизистой оболочки камнем или уретероскопом во время диагностического или терапевтического вмешательства приводит к обнажению клеток подслизистого слоя и их гиперплазии. Такое усиленное деление клеток, имеющее изначально цель закрыть дефект, нередко приводит к неблагоприятному результату и значительно уменьшает просвет мочеточника, нарушая пассаж мочи, приводя к обструкции и гидроуретеронефротической трансформации ВМП.
С тех пор, как лечение стриктур мочеточников ограничивалось исключительно открытыми хирургическими техниками, прошло много времени. Технический прогресс, ускоренный ритм жизни и возросшее внимание к экономической стороне лечебного процесса привели к тому, что в настоящее время лечение стриктур мочеточников невозможно представить без использования эндоскопических технологий. Именно эти малоинвазивные техники позволили значительно уменьшить смертность, длительность госпитализации и периода нетрудоспособности у больных, перенесших оперативное лечение патологических сужений верхних мочевыводящих путей.
Понятие «протяженности» стриктуры крайне важно для определения тактики ведения больных с данной патологией. Так, стриктуры менее или равные 2.0 см принято считать непротяженными, и в их коррекция может быть осуществлена «минимально инвазивно», т.е. с применением эндоскопических методов лечения [7, 11]. При протяженности суженного участка более 2 см шансы на успех «внутрипросветных» манипуляций стремятся к нулю, что открывает дорогу для использования как эндоскопических, так и открытых методов пластики мочеточника.
В настоящее время уролог не ограничен в выборе методов лечения непротяженных стриктур мочеточников. В арсенал хорошо оснащенного урологического центра обычно входят такие эндоскопические техники коррекции этой патологии как бужирование, эндоуретеротомия с использование холодного ножа, электроножа и лазерного волокна. Однако, при наличие такого разнообразия методик ведения больных с непротяженными стриктурами мочеточников не существует установленных алгоритмов, схем или единственной оптимальной техники. Все методы лечения непротяженных стриктур мочеточников не достаточно радикальны, что является их существенным недостатком. Рецидивирование стриктуры – это проблема номер один для специалиста в области лечения этого заболевания.
Именно поэтому, целью данной работы стало улучшение результатов лечения больных со стриктурами мочеточников путем определения и сравнения эффективности различных методов эндоскопического лечения данного заболевания.
Материалы и методы. В период с 2007 по 2011 г. в СПб «Городском центре эндоурологии и эндоскопических технологий Санкт-Петербурга» СПб ГБУЗ «Клиническая больница имени Святителя Луки (профессора медицины В.Ф. Войно-Ясенецкого)» было выполнено 125 эндоскопических операций по поводу непротяженных стриктур мочеточников у 103 больных. При этом 103(82.4%) вмешательства произведены как «первичные», и 22(17.6%) выполнено повторно с целью коррекции рецидива. Из пролеченных пациентов 48 женщин, что составило 46.6% и 55 мужчин, что составило 53.4%. Средний возраст больных составил 47.7±15 лет.
У 88 (85.4%) больных диагноз стриктуры мочеточника был установлен в ходе комплексного клинико-лабораторного урологического обследования, включающего рутинные исследований, принятые для диагностики обструктивных заболеваний ВПМ (в том числе и ультразвуковое исследование (УЗИ) ВМП, экскреторную урографию и уретероскопию).
У 15 (14.6%) больных диагноз стриктуры мочеточника был установлен интраоперационно в ходе выполнения эндоскопических вмешательств на мочевыводящих путях по поводу МКБ (эндоуретеролитотрипсии). В этом случае патологическое сужение мочеточника было диагностировано только по визуальной оценке.
Самым частым первичным диагнозом при госпитализации больных был «Мочекаменная болезнь. Почечная колика». У 55 пациентов, что составило (53.4%), симптоматика соответствовала «почечной колике». У 17(16.5%) больных «острый пиелонефрит» или «хронический пиелонефрит, активная фаза» фигурировали в качестве первичного диагноза.
В среднем количество дней, проведенных больным в стационаре до оперативного вмешательства, составило 4.7±3 дня.
Из 103 пациентов у 61 (59.2%) стриктуры мочеточника имели воспалительную этиологию и возникали на фоне длительного анамнеза мочекаменной болезни с множественными эпизодами пассажа камней и почечных колик. Однако, 17 больных (16.5%) с воспалительным генезом стриктур не имели никаких проявлений мочекаменной болезни. В 1 случае стриктура мочеточника была туберкулёзной природы, а в другом - экстрагенитальным эндометриозом, что составило 0.9% для каждой патологии. Больные с ятрогенными сужениями мочеточника составляли 10.7% (11 человек).Все эндоскопические вмешательства выполнялись по одному алгоритму: после бужирования устья мочеточника, в просвет органа вводился полуригидный уретеропиелоскоп, осуществлялся осмотр стенки мочеточника и непосредственно места его сужения. Затем суженный участок бужировался с применением баллонного дилататора или рассекался в пределах неизмененных тканей на всю толщину стенки до периуретерального жира с применением холодного ножа, электроножа или лазерного волокна. Из выполненных 103 первичных вмешательств в 32 случаях (31.1%) выполнялась эндоуретеротомия «холодным ножом», в 26 (25.3%) – лазером, в 21(20.4%) случаях рассечение стриктуры производилось электроножом, в 24 (23.3%) выполнялось бужирование суженого участка мочеточника. Если у пациентов было диагностировано сочетание камней ВМП, почек и стриктуры мочеточника, эндоуретеротомия сочеталась с контактной литотрипсией. Длительность эндоуретеротомии была от 5 до 15 минут, в среднем 11.6±7.1 мин. В случаях, когда рассечение стриктуры сочеталось с литотрипсией продолжительность вмешательства увеличивалась до 70±12.6 минут.
У всех больных эндоуретеротомия заканчивалась стентированием мочеточника. Размер стента определялся видом операции, наличием интраоперационных осложнений, предполагаемыми сроками послеоперационного стентирования. При выполнении эндоуретеротомии и бужирования использовались стенты различного диаметра, соответствующего степени расширения мочеточника выше стриктурированного участка. Длительность стояния стента была от 6 до 9 недель, в среднем 6.9±1.1 недель. Во всех случаях после установки уретерального стента мочевой пузырь катетеризировался катетером Фолли.
Послеоперационный период протекал гладко в большинстве случаев. Так, у 86 (83.4%) пациентов не возникло необходимости в использовании наркотических анальгетиков в послеоперационном периоде. У остальных 16.4% больных потребовалась введение ненаркотических анальгетиков. Лихорадка осложнила течение послеоперационного периода в 12 случаях (11.7%).
Непосредственно в исследование был включен 91 человек (88.3%), поскольку 12 человек от участия в исследовании после операции отказались. Сроки наблюдения составили от 3 до 60 месяцев, средний срок наблюдения – 18.8±11 месяцев.
Все больные были распределены в 4 группы на основании конкретного метода эндоскопического лечения. Сравнительная характеристика групп дана в табл. 1.
Таблица 1. Характеристики групп пациентов
Для обработки результатов был использован пакет статистических программ STATISTICA 7.0.
Оценка эффективности метода складывалась из суммы ближайших и отдаленных результатов. Ближайшие результаты определялись по осложненности послеоперационного периода фебрильной лихорадкой и значительным болевым синдромом, требующим введения наркотических анальгетиков.
Ранние осложнения послеоперационного периода встречались в каждой группе больных, и были распределены равномерно. Частота возникновения осложнений была признана одинаковой во всех группах (p≤0.05). Кроме того, были обнаружены зависимости между частотой возникновения лихорадки и болевого синдрома от отягощенности анамнеза хроническими воспалительными процессами чашечно-лоханочного сегмента (r=0.47, p≤0.05) и протяженностью стриктуры мочеточника (r=0.25, p≤0.05).
Из всех проведенных вмешательств по поводу непротяженных стриктур мочеточника неудовлетворительные отдаленные результаты (т.е. рецидив) были получены в 22 случаях (24.2%). Таким образом, общая эффективность всех эндоскопических методов составила 75.8%. Частота развития рецидива стриктур мочеточника, вне зависимости от метода коррекции, соотносится с диаметром стента (r=-0.39, p≤0.05), уровнем лейкоцитурии на 3 сутки после операции (r=0.55, p≤0.05) и степенью гидронефроза (r=0.80, p≤0.05). Полученные результаты представляются логичными и соотносятся с данными мировой литературы [3,8,10].
Уровень лейкоцитурии на 3 сутки может служить прогностическим критерием рецидивирования стриктуры мочеточника. Так, количество лейкоцитов в моче на 3сутки после вмешательства было значимо выше во всех группах у тех больных, у которых в последствии произошло рецидивирование патологического сужения мочеточника. Этому факту мы даем следующее объяснение: значимая лейкоцитурия в послеоперационном периоде отражает активацию воспалительного процесса ВМП, которое стимулирует пролиферацию фибробластов и формирование рубцов. Не исключено, что лейкоцитурия может быть всего лишь показателем недавнего повреждения эндоскопическими инструментами стенки мочеточника в ходе вмешательства. Однако не замечено никакой корреляции между уровнем лейкоцитурии и агрессивностью проведенной операции (r=0.01, p≤0.05).

Рис. 1. Зависимость частоты рецидивирования стриктур от уровня лейкоцитурии. Группа «Х».

Рис. 2. Зависимость частоты рецидивирования стриктур от уровня лейкоцитурии. Группа «Л».
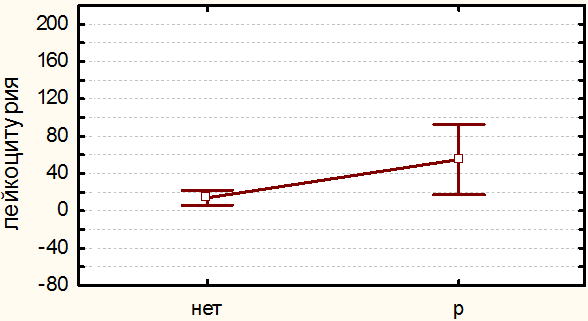
Рис. 3. Зависимость частоты рецидивирования стриктур от уровня лейкоцитурии. Группа «П».
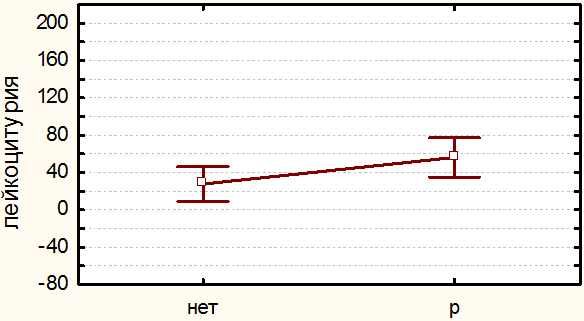
Рис. 4. Зависимость частоты рецидивирования стриктур от уровня лейкоцитурии. Группа «Б».
Средний диаметр стента составил 8.1±3.1 F. Было отмечено, что именно размер стента, а не длительность его стояния, имеет влияние на рецидивирование стриктуры мочеточника (r= -0.39, p≤0.05). Таким образом, для повышения успешности лечения стриктуры, диаметр мочеточникового стента должен подбираться адекватно размеру измененного мочеточника. При наличие сомнений при выборе стента, предпочтение должно отдаваться стенту большего диаметра.
В группе «Х», где для эндоуретеротомии использовался холодный нож, стриктура эффективность лечения составила 88.5% случаев (3 случая рецидивирования стриктуры). В группе «Л», где для рассечения суженого участка мочеточника применялась энергия лазерного волокна, положительный эффект был достигнут в 81.8% случаев (рецидивирование стриктуры у 4 больных). В группе «П», в которой инцизия была обеспечена электроножом, 71.4% вмешательств были успешны (6 случаев повторного возникновения стриктуры). В группе «Б», где стриктуры бужировались, успех был, достигнут только в 59.1% случаев (у 9 больных появление стриктуры мочеточника повторно).
Исключительно для группы «Б» была показана зависимость частоты рецидивирования от протяженности стриктуры мочеточника (r=0.6 p≤0.05). Было показано, что средняя протяженность стриктуры, после бужирования которой возникал рецидив больше, чем протяженность стриктуры мочеточника, бужирование которого было эффективно. Так, средняя длина стриктур, бужирование которых было успешно, составила 0.92±0.3 см. Рецидивировавшие после бужирования стриктуры имели среднюю протяженность 1.58±0.25 см. Из этих данных может быть сделан практический вывод о нежелательности применения бужирования в лечении стриктур мочеточника протяженностью более 1 см.
При анализе полученных результатов, сгруппированных по этиологии стриктуры мочеточника, было показано, что эффективность лечения ятрогенных стриктур значительно зависит от конкретного способа эндоуретеротомии (r=0.7, p≤0.05). Так, бужирование таких стриктур оказалось неэффективным в 100% случаев, а все стриктуры, скорректированные с помощью «холодного ножа», не рецидивировали. Таким образом, очевидно, что при выборе эндоскопического метода лечения ятрогенных стриктур следует отдать предпочтение любому методу, кроме бужирования.
Заключение. После проведения комплексного анализа ближайших и отдаленных результатов лечения непротяженных стриктур мочеточников различными эндоскопическими методами, были сделаны следующие выводы:
- Эффективность эндоскопических методов лечения непротяженных стриктур мочеточников - 75.8%. Принимая во внимание их значительную экономическую эффективность и меньшее количество интра- и послеоперационных осложнений по сравнению с открытыми техниками коррекции, может быть сделано заключении о том, что именно эндоскопические методы лечения непротяженных стриктур мочеточника являются «операцией выбора» или «операцией первой линии» в коррекции данной патологии.
- Наиболее эффективно применение «холодного ножа» для эндоуретеротомии (11.5% рецидивирования). Лишь немного в эффективности уступает эндоуретеротомия с использованием энергии лазерного волокна (18.2% рецидивирования). Результаты применения бужирования для лечения непротяженных стриктур мочеточников оказались весьма неудовлетворитеными (40.9% рецидивирования).
- Прогностическими критериями эффективности эндоскопических методов лечения непротяженных стриктур мочеточников являются размер мочеточникового стента, уровень лейкоцитурии на 3 сутки, степень гидронефроза, наличие нефростомы.
- Бужирование, как монометод лечения, не эффективен в случае ятрогенной этиологии возникновения стриктур, а также при протяженности стриктуры более 1 см.
Необходимо отметить, что некоторые из вышеперечисленных выводов имеют значительное практическое применение и при соблюдении определенных технических условий могут значимо улучшить результаты лечения больных с непротяженными стриктурами мочеточников. Однако, вывод о превосходстве по эффективности эндоуретеротомии с помощью «холодного ножа» над лазерным волокном достаточно абстрактен и требует более детального изучения в исследовании с большей выборкой. Он не должен достоверно и изолированно приниматься во внимание при решении вопроса о техническом обеспечении эндоурологической операционной без анализа дополнительных характеристик оборудования (стоимость, износостойкость, эргономичность и т.д.).
