Введение. Расстройства мочеиспускания, в том числе инфравезикальная обструкция (ИВО), являются наиболее частым осложнением брахитерапии (БТ) рака предстательной железы (РПЖ) [17]. Ситуацию усугубляет тот факт, что РПЖ - заболевание мужчин старшей возрастной группы, имеющих помимо злокачественной опухоли еще и доброкачественную гиперплазию предстательной железы (ДГПЖ) со всеми характерными для нее симптомами [1, 2, 7, 8, 11]. Многочисленные исследования, посвященные данной теме, позволили выделить факторы риска развития инфравезикальной обструкции в постимплантационном периоде, основанные на оценке исходного состояния нижних мочевых путей [5, 10, 13, 18, 22, 28, 33]. Такими факторами принято считать [10, 14, 20, 29]: суммарный балл IPSS более 12-20, максимальную скорость мочеиспускания (Qmax) менее 10 мл/сек, объем остаточной мочи (ООМ) более 50-200 см3 и объем ПЖ более 50-60 см3.
Целью профилактики ИВО является максимально возможная коррекция исходно имеющихся у пациента факторов риска. Традиционно с этой целью используется неоадъювантная гормональная терапия (ГТ), наиболее оптимальным режимом которой считается максимальная андрогенная блокада (МАБ) сроком на 3 месяца [15, 24]. Имеющиеся исследования позволяют говорить, что такое лечение эффективно уменьшает объем ПЖ, однако не исключает уродинамические расстройства в постимплантационном периоде, вплоть до развития острой задержки мочеиспускания (ОЗМ) [6, 13, 25, 26, 31]. Кроме этого, такая терапия достаточно токсична [27]. В связи с этим, назначение гормональной терапии с целью профилактики развития ИВО при планировании БТ не соответствует клиническим требованиям.
Альтернативным методом профилактики ИВО может быть трансуретральная резекция предстательной железы (ТУР ПЖ). Данная операция позволяет уменьшить объем простаты и устранить обструктивные симптомы у больных РПЖ [12, 21, 23, 30, 32], при этом не оказывая негативного влияния на течение основного заболевания [3, 4, 9, 16, 34]. Тем не менее, ряд исследователей связывает наличие ТУР ПЖ в анамнезе с развитием недержания мочи в постимплантационном периоде [19]. На наш взгляд, данное утверждение является спорным, а частота развития осложнений зависит от методики и объема операции, а также от срока между выполнением ТУР ПЖ и имплантацией источников. В настоящее время среди исследователей отсутствует единое мнение по этому вопросу, и он требует дальнейшего изучения.
Цель исследования: разработать подход к планированию БТ под контролем стереотаксической приставки к компьютерному томографу (КТ) у больных локализованным РПЖ с высоким риском развития ИВО в постимплантационном периоде.
Материалы и методы. В исследование было включено 43 пациента, которым с целью профилактики постимплантационных уродинамических осложнений перед БТ выполнена ТУР ПЖ. Средний возраст пациентов составил 67,5±5,9 лет. У всех больных был выявлен локализованный РПЖ, отсутствовали отдаленные метастазы. Исходный уровень простатического специфического антигена (ПСА) в среднем составил 10,9 ±4,6 нг/мл.
Факторы риска развития уродинамических осложнений после БТ, выявленные у пациентов, представлены в табл. 1.
Таблица 1. Факторы риска развития постимплантационных уродинамических осложнений

Один фактор риска развития постимплантационных уродинамических осложнений наблюдался только у 4 (9,3%) пациентов, большинство больных имели различные сочетания, в том числе у 6 (13,9%) имелось сочетание сразу всех факторов.
На момент начала исследования средний объем ПЖ составлял 84,6±23,4 (от 41 и до 124) см. куб. Были зафиксированы следующие исходные показатели урофлоуметрии: максимальная скорость мочеиспускания - 11,5±3,5 (от 7 до 19) мл/сек, средняя скорость - 4,2±1,9 (от 2 до 9) мл/сек., при объеме мочеиспускания (Vv) - 179,0±24,3 (от 148 до 220) мл. Средний ООМ равнялся 97,2±71,4 (от 5 и до 275) см. куб.
Суммарный балл IPSS в среднем составил 11,8±5,7 (от 2 и до 19), балл выше 15 отмечен у 14 (32,5%) мужчин. Исходно превалировали симптомы раздражения нижних мочевых путей, особенно ноктурия (2,5 балла). Наиболее выраженными обструктивными симптомами явились чувство неполного опорожнения мочевого пузыря и вялая струя мочи - 1,8 и 2,4 балла, соответственно. Остальные симптомы отмечались в среднем менее чем в 20% случаев. Наихудшие значения IPSS наблюдались у пациентов, имеющих сочетание всех факторов риска - 17,8±0,75 (от 17 до 19) баллов.
На вопрос о том, как бы пациент чувствовал себя, если бы имеющиеся симптомы сохранялись до конца жизни (QoL), негативное отношение высказали 18 (41,8%) больных, 14 (32,5%) выбрали положительный вариант, 11 (25,6%) опрошенных затруднились с ответом.
ТУР ПЖ выполнялась по разработанной нами методике (заявка на изобретение № 2011138818, приоритет 21/09/2011 г): наиболее тщательно резецировались ткани в области шейки мочевого пузыря и «средняя доля» ПЖ с формированием «мочевой дорожки». Боковые доли, особенно в области апикальных отделов, резекции не подвергались. Такая методика, на наш взгляд, обеспечивая нормализацию мочеиспускания, в дальнейшем позволяет избежать технических сложностей, связанных с имплантацией источников в область «средней доли». При этом не происходит формирования большого «предпузыря» и сохраняется необходимый объем ткани для имплантации достаточного количества источников и создания адекватной дозы облучения. Кроме того, подобная методика позволяет снизить риск развития недержания мочи в постимплантационном периоде.
Оценка результатов ТУР проводилась через 3 месяца, после чего выполнялась брахитерапия. Имплантация источников осуществлялась под контролем КТ с использование стереотаксической приставки, которая была усовершенствована нами с целью обеспечения наибольшей точности имплантации (патент на полезную модель № 130854, приоритет 21/09/2011).
В ходе динамического наблюдения выполнялось следующие обследования:
- трансректальное ультразвуковое исследование (ТР УЗИ) органов малого таза;
- урофлоуметрия с измерением ООМ;
- определения уровня ПСА сыворотки крови;
- заполнение вопросника IPSS.
Анализ острых лучевых повреждений по классификации RTOG проводился через три месяца после имплантации источников. В конце исследования оценивались поздние лучевые осложнения.
Результаты.
Длительность ТУР ПЖ составила 46,3±19,9 (от 20 и до 80) минут и не коррелировала с объемом предстательной железы (коэффициент корреляции 0,05, р>0,05). Интраоперационных осложнений зафиксировано не было.
Средняя продолжительность катетеризации мочевого пузыря после операции составила 4,7±1,9 (от 3 до 7) суток, при длительности орошения 4,1±1,7 (от 2 до 6) суток. Самостоятельное мочеиспускание после удаления уретрального катетера восстановилось у всех 43 (100%) больных.
Через 1 месяц после электрорезекции 42 (97,7%) пациента полностью удерживали мочу. У 1 (2,3%) больного отмечалось недержание, что, с учетом быстрой положительной динамики, было связано нами с излишней электротравмой сфинктерного аппарата в результате значительного объема и длительности резекции (80 минут при исходном объеме ПЖ 88 см. куб.). У данного пациента полный контроль за мочеиспусканием был достигнут только через 4 месяца после ТУР.
У всех пациентов ежемесячно после ТУР осуществлялся контроль ПСА. Повышение ПСА зафиксировано только у 2 (4,6%) больных, но учитывая, что прирост к исходному уровню в среднем составил 1,65 нг/мл за весь срок наблюдения, какая-либо дополнительная терапия этим больным не назначалась.
Влияние ТУР на факторы риска развития инфравезикальной обструкции.
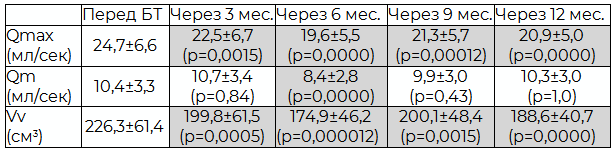
При контрольном обследовании через 3 месяца после ТУР были получены следующие данные: средний объем ПЖ составил 35,6±12,5 (от 15,4 до 54) см. куб. - на 49 см. куб. меньше исходного (р=0,00). ООМ уменьшился на 89 см. куб. и при контрольном измерении равнялся 8,2±10,5 (от 0 до 44) см. куб (р=0,00). Максимальная скорость мочеиспускания составила 24,7±6,6 (от 16 до 38) мл/сек, средняя – 10,4±3,3 (от 7 до 18) мл/сек, что оказалось больше исходных значений на 13,2 и 6,2 мл/сек, соответственно (р=0,00). Также отмечено увеличение емкости мочевого пузыря на 47 мл, с 179,0±24,3 (от 148 до 220) мл перед ТУР до 226,3±61,4 (от 154 до 363) мл при контрольном измерении (р=0,01). Все различия оказались достоверными.
Суммарный балл IPSS через 3 месяца после ТУР в среднем равнялся 4,7±2,7 (от 2 до 12) и у всех пациентов был ниже 15. По-прежнему преобладали симптомы раздражения нижних мочевых путей: мочеиспускание в ночное время отмечалось в среднем 1,6±0,7 (от 0 и до 3) раз, учащенное мочеиспускание сохранялось в 20 - 50% случаев - 1,2±0,8 (от 0 и до 3) баллов. Остальные симптомы встречались менее чем в 20% случаев.
На вопросник QoL большинство пациентов (34,9%) ответили «хорошо», только 4 (9,3%) пациента отметили вариант «плохо» и ни один не отметил «очень плохо». В среднем, балл QoL уменьшился на 1,7: с 3,2±1,3 перед ТУР до 1,5±1,3 через 3 месяца после резекции (р=0,00).
К моменту проведения брахитерапии, ни один из 43 пациентов не имел факторов риска развития уродинамических осложнений в постимплантационном периоде.
Брахитерапия
БТ была выполнена всем пациентам через 13,7±3,3 (от 11 до 23) недель после ТУР ПЖ. Среднее время имплантации составило 36,4±5,4 (от 30 до 45) мин.
У всех больных СОД была не менее 145 Гр, Д90 109,7±5,5 (от 101,7 до 118,4). Среднее количество игл, использованных при имплантации, составило 24,4±2,8 (от 20 до 30), а количество источников – 70,6±9,5 (от 54 до 86).
При выполнении БТ не было зафиксировано значимых интра- и постоперационных осложнений. У всех больных после удаления катетера восстановилось самостоятельное мочеиспускание, пациенты были выписаны на амбулаторное лечение через 3,1±0,3 (от 2 и до 4) суток после имплантации.
Постимплантационное наблюдение
Все пациенты проходили контрольное обследование через 3, 6, 9 и 12 месяцев после БТ.
Динамика объема ПЖ представлена на графике (рис. 1). Перед проведением брахитерапии средний объем ПЖ составлял 35,6±12,5 см. куб., а к третьему месяцу после имплантации источников он достоверно увеличился до 41,7±12,9 см. куб. (р= 0,000012), что явилось максимальным показателем за весь период контрольного наблюдения. При дальнейших измерениях достоверных изменений объема, зафиксированного перед БТ, не наблюдалось (р = 0,05; 0,29; 0,29). К девятому месяцу достигнуто минимальное значение размеров ПЖ в постимплантационном периоде - 37,7±12,4 см. куб., однако к 12-му месяцу наметилась некоторая тенденция к увеличению объема, который к этому сроку составил 38,8±11,7 см. куб.
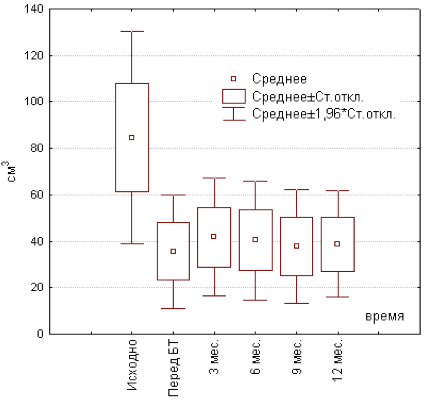
Рис. 1. Динамика объема предстательной железы после БТ.
ОМ достоверно уменьшился с 97,2±71,4 см. куб. после ТУР до 8,2±10,5 см. куб. перед выполнением БТ (р=0,00). При контроле через 3, 6, 9 и 12 месяцев после брахитерапии достоверных изменений показателя не выявлено (р=0,69, р=0,24, р=0,24 и р=0,4 соответственно).
Максимальное ухудшение значений Qmax, Qm и Vv достоверно отмечено через 6 месяцев после БТ. В дальнейшем, несмотря на то, что Qm и оставалась несколько ниже предимплантационного уровня, но достоверно от него не отличалась. Значения Vv и Qmax на всем протяжении исследования были достоверно ниже уровня, зафиксированного перед проведением брахитерапии (табл. 2). Однако, при этом у всех показателей, начиная с шестого месяца после брахитерапии, прослеживалась некоторая положительная динамика, особенно выраженная при контрольном обследовании через 9 мес. после имплантации.
Таблица № 2. Динамика показателей урофлоуметрии
Анализ данных IPSS показал, что наибольшее число жалоб, связанных с расстройством мочеиспускания, пациенты предъявляли через 3 месяца после имплантации источников. Средний балл в этой контрольной точке составил 9,7±5,3, что достоверно выше уровня, зафиксированного перед брахитерапией (p=0,000047). Начиная с 6 месяцев после установки источников, наблюдается стойкая положительная динамика. Через 9 и 12 месяцев балл IPSS равнялся 5,7±4,2 и 4,8±3,8, соответственно, и достоверно не отличался от предимплантационного значения (р=0,25 и 0,53). Следует отметить, что на всех этапах исследования симптомы раздражения нижних мочевых путей превалировали над обструктивными симптомами: максимальный дискомфорт пациенты испытывали в связи с императивными позывами, учащенным мочеиспусканием и ноктурией.
Изменения качества жизни (QoL) коррелировало с динамикой IPSS. Худший показатель - 2,6±1,5 - зафиксирован через 3 месяца после выполнения брахитерапии. Начиная с 6 месяцев после имплантации отмечена отчетливая положительная динамика QoL, который достоверно не отличался от предимплантационного уровня, хотя и оставался несколько выше.
Ранние и поздние лучевые повреждения по классификации RTOG/EORTC
На ранних сроках после имплантации основным осложнением со стороны органов мочеполовой системы явилась ноктурия, которую отметило подавляющее большинство пациентов - 81,4%. При этом, жалобы на ночное мочеиспускание у 19 (44,2%) больных были квалифицированны нами как вторая степень осложнений (RTOG/EORTC). Учащенное мочеиспускание и дизурия различной степени выраженности также отмечались достаточно часто: в 67,4 и 76,7 процентах случаев, соответственно. Боли в области малого таза, спазмы мочевого пузыря, а также макрогематурия, отмечались сравнительно реже - в 37,2% и 30,1% случаев. Следует отметить, что большинство (89,7%) ранних радиационных повреждений мочеполовой системы относились к 1 и 2 степени, осложнения 3 степени наблюдались только в 10,3% случаев, а острых осложнений 4 степени зафиксировано не было.
Ранние лучевые повреждения ЖКТ встречались значительно реже - суммарно в 39 случаях, против 126 случаев повреждения мочеполовой системы. При этом только 5,1% жалоб были квалифицированны как 3 степень осложнений, 94,9% относились к 1 и 2 степени. В большинстве случаев пациенты отмечали незначительное расстройство стула и болезненные ощущения в области прямой кишки (39,5% и 37,2%). В единичных случаях отмечалось выделение слизи и крови из прямой кишки.
Наиболее частым поздним лучевым осложнением 1 степени явилась микрогематурия, которая наблюдалась у 11 (25,6%) пациентов. При этом видимую примесь крови в моче отметил только 1 (2,3%) больной. Среди осложнений 2 степени следует выделить дизурию, отмеченную 6 (13,9%) мужчинами.
Как и в случае с ранними повреждениями, суммарно поздние расстройства ЖКТ встречались реже, чем осложнения со стороны мочевой системы - 10 против 53. Наиболее часто пациенты отмечали легкое расстройство стула, не требующее медикаментозной коррекции. Только один больной жаловался на боли в области прямой кишки, еще 2 пациента отмечали периодические слизистые выделения.
Отдельного внимания заслуживают 4 (9,3%) пациента, у которых состояние нижних мочевых путей к моменту окончания исследования соответствовало 3-4 степени по шкале оценки поздних лучевых осложнений RTOG/EORTC: выраженный геморрагический цистит и уменьшение емкости мочевого пузыря до 100 - 150 мл у 3 больных и менее 100 мл у 1 пациента. Всем пациентам проводилась комплексная терапия, согласно рекомендациям, предложенным в ФГУ "Российский научный центр радиологии и хирургических технологий" [Гранов А.М., 2002, Метелев B.B., 2005]. За время наблюдения у этих мужчин наметилась некоторая положительная динамика, однако несмотря на это, через 12 месяцев после имплантации источников среднее значение IPSS составило 16,5 баллов, а QoL равнялся 4,25. Анализ, направленный на выявление факторов, оказывающих негативное влияние на итоговое значение IPSS, показал достоверное влияние следующих показателей: объем предстательной железы перед выполнением брахитерапии менее 30 см. куб. (p=0,04), балл IPSS перед выполнением брахитерапии более 10 (p=0,00) и СОД более 165 Гр (p=0,02).
Другие осложнения
С учетом литературных данных, наиболее ожидаемым осложнением являлось недержание мочи. Несмотря на это, подобные жалобы предъявил только 1 (2,3%) больной, у которого в течение первого месяца после имплантации источников развилось недержание мочи, которое потребовало использования 2-3 прокладок в сутки и прослеживалось на протяжении всего срока исследования. Еще у 3 (7,0) пациентов отмечались эпизоды неудержания мочи, связанные с выраженными императивными позывами. К моменту окончания исследования подобные жалобы предъявлял только один больной.
Динамика ПСА
В постимплантационном периоде отмечалось достоверное снижение уровня ПСА сыворотки крови при каждом контрольном измерении. Через 12 месяцев после БТ среднее значение показателя составило 0,7±0,4 (от 0,2 до 1,4) нг/мл. В ходе исследования данных за рецидив РПЖ не получено ни у одного пациента.
Выводы
- ТУР ПЖ за счет уменьшения объема ПЖ, повышения скорости мочеиспускания и снижения ООМ, является эффективным методом устранения факторов риска развития ИВО у пациентов с локализованным РПЖ, которым планируется выполнить БТ.
- Выполнение ТУР по предложенной методике позволяет подвести необходимую (СОД>145 Гр) дозу облучения и не приводит к развитию недержания мочи в постимплантационном периоде.
- Динамика ПСА, отмеченная в ходе исследования, позволяет говорить об отсутствии негативного влияния ТУР на прогрессию РПЖ.
