Актуальность проблемы. Проблема хронического простатита в настоящее время приобрела особую актуальность по ряду экологических, социальных и этико-моральных причин, существенно увеличивших заболеваемость. Важность проблемы связана также с тем, что воспаление предстательной железы может значительно нарушать ее функции, обеспечивающие мужскую фертильность, что в конечном итоге приводит к ухудшению демографических показателей [1,6].
Немаловажную роль в развитии хронического простатита играют недостаточность артериального кровообращения, обилие анастомозов между венами предстательной железы (ПЖ) и венозной системой таза [1,4,5]. Нарушение гемодинамики предстательной железы способствует нарушению антиоксидантной защиты, секреторной, инкреторной и моторной функций [8], что приводит к увеличению объема ПЖ, усугубляет стаз в микроциркуляторном русле, способствует появлению отека, экссудации и миграции форменных элементов крови через сосудистую стенку. Известно, что регуляция сосудистого тонуса осуществляется с участием активных форм кислорода, а нарушение микроциркуляции может быть отражением дисбаланса в продукции вазоконстрикторов и вазодилататоров. Увеличение содержания активных форм кислорода при ХП приводит к накоплению супероксида простаты, тем самым увеличивая проницаемость сосудов и вызывает нарушение гематопростатического барьера [3]. Если снижается количество ионов цинка, то активность антиоксидантных ферментов падает [3].
Трудности лечения хронического простатита обусловлены тем, что наличие гематопростатического барьера не позволяет антибактериальным препаратам проникать в паренхиму простаты [5,6,7]. Кроме того, сложная анатомия мочеиспускательного канала, восходящая инфекция из которого является частой причиной развития хронического простатита, из-за образования замкнутых полостей с изолированными в них микроорганизмами служит частой причиной рецидива заболевания и неэффективности лечения [1].
Определяющим в терапии больных хроническим простатитом наряду с ликвидацией воспалительного процесса является улучшение кровообращения в предстательной железе, повышение иммунологической реактивности [4]. В связи с этим, оправданным для лечения хронического простатита является комплексное лечение с применением фармако- и пелоидотерапии. При ректальном использовании пелоидотерапии оказывается воздействие на рецепторы слизистых оболочек, обусловливая мощную афферентацию в центральную нервную систему, лимбико-ретикулярную формацию, вызывая стимуляцию гормонального звена рефлекторно-гуморального пути.
Цель исследования: разработать и патогенетически обосновать комбинированное использование фармако- и пелоидотерапии при хроническом простатите.
Материалы и методы исследования. Под нашим наблюдением находилось 40 больных ХП в возрасте от 22 до 45 лет.
Больные самостоятельно заполняли международную систему суммарной оценки ХП (IPSS), сексуальную формулу мужчины (СФМ) по Г.С. Васильченко.
При андрологическом обследовании особое внимание уделяли заболеваниям половых органов (простатит, везикулит, уретрит), которые способны вызывать ХП. Отмечали состояния, способствующие развитию конгестивных явлений в органах малого таза (малоподвижный образ жизни, заболевания вен). Кроме того, выясняли наличие хронической интоксикации, злоупотребление алкоголем, перенесённые травмы половых органов, головного мозга, венерические заболевания.
При общем осмотре больного оценивали сомато-биологическое развитие, индекс массы тела, который высчитывался по формуле: вес (кг)/рост2.
Обследование половых органов заключалось в осмотре полового члена и органов мошонки, исследовании ПЖ. При осмотре полового члена отмечали отсутствие или наличие пороков развития (гипоспадии, эписпадии), состояние крайней плоти и наружного отверстия мочеиспускательного канала. При обследовании мошонки обращали внимание на ее размеры, степень отвисания, выраженность или отсутствие складчатости и пигментации; после этого определяли положение яичек в мошонке и состояние их придатков.
Пальцевое исследование ПЖ и семенных пузырьков проводили в коленно-локтевом положении больного, на боку (обычно на правом) и в положении больного стоя с наклоном вперёд на 900. При пальпации придатка яичка отмечали состояние головки, тела, хвоста на предмет наличия или отсутствия его увеличения, уплотнения или деформации. При пальпации семенного канатика определяли толщину и гладкость семявыносящих протоков, а также наличие или отсутствие извитых расширенных вен.
Ультразвуковое исследование (УЗИ) осуществлялось общепринятым способом с последовательным проведением трансабдоминального и трансректального УЗИ.
При ультразвуковом цветном допплерографическом картировании в капсулярных и уретральных артериях ПЖ оценивали максимальную систолическую скорость кровотока (Vmax), минимальную диастолическую скорость кровотока (Vmin), индекс пульсации (IP) и индекс резистентности (IR). Также изучали плотность сосудистого сплетения (ПСС), скорость кровотока и диаметр парапростатических и параректальных вен ПЖ.
Оценку микроциркуляции в ПЖ и мочеиспускательном канале проводили методом лазерной допплеровской флоуметрии (ЛДФ).
Урофлоуметрия выполнялась с изучением средней (Qaver) и максимальной (Qmax) скоростей потока мочи.
Определение порога болевой чувствительности проводилось путем регистрации показателей микроамперметра при появлении у пациента ощущения боли, в результате дозированного, постепенно возрастающего воздействия на исследуемую область прямоугольных импульсов постоянного тока. Сравнивались показатели в актуальных (область локализации боли) и нейтральных зонах.
Для осмотра передней и задней уретры выполнялась уретроскопия.
Для исключения заболеваний, передающихся половым путем (хламидиоз, уреаплазмоз, микоплазмоз), брался соскоб из уретры для последующего исследования поверхностной цитозольной реакцией. С целью исключения доброкачественных заболеваний ПЖ изучали концентрацию сывороточного простатспецифического антигена (ПСА) иммуноферментным методом. Исследование нативного препарата секрета ПЖ проводилось после массажа ПЖ.
Активность антиоксидантной системы изучали по концентрации супероксиддисмутазы, каталазы, глутатионпероксидазы, глутатионредуктазы ферментативным колориметрическим тестом.
Для изучения иммунологической реактивности производили содержание иммуноглобулинов А, Е, М и G методом нефелометрии, циркулирующих иммунных комплексов (ЦИК), содержание sIgA в секрете ПЖ определяли методом радиальной иммунодиффузии, содержание интерлейкина ИЛ-4 в сыворотке крови и секрете ПЖ производилась методом твердофазного иммуноферментного анализа.
Больные были разделены методом рандомизации на 2 группы. Все больные получали массаж предстательной железы, ЛФК по методу Л.А. Бутченко и О.Л. Тиктинского [2].
1-я группа (40 больных) получала лимфотропную терапию простатиленом (2,0 мл, через день, №10), подкожные инъекции алоэ (1,0 мл, через день, №10), внутримышечные инъекции циклоферона (2,0 мл, 1 раз в 5 дней, №5), аевит (по 1 капсуле 3 раза в день – 20 дней).
2-я группа (40 больных) дополнительно к фармакотерапии получала пелоидотераию. Лечебную грязь Тамбуканского озера температурой 40-42°С применяли в виде ректальных тампонов и аппликаций «трусов». Процедуры проводились через день, на курс лечения - 10 процедур.
Результаты и обсуждение. У больных ХП возраст в среднем составил 37,3±1,2 лет, длительность ХП - 4,5±1,1 года.
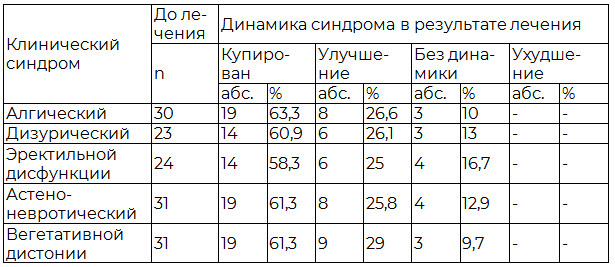
Под влиянием фармако- и пелоидотерапии болевой синдром купирован у 19 (63,3%) из 30 (75%), дизурический – у 14 (60,9%) из 23 (57,5%), эректильной дисфункции – у 14 (58,3%) из 24 (60%), астено-невротический – у 19 (61,3%) из 31 (77,5%), вегетативной дистонии – у 19 (61,3%) из 31 (77,5%) больного (табл.1).
Таблица 1. Влияние фармако- и пелоидотерапии на течение клинических синдромов у больных хроническим простатитом
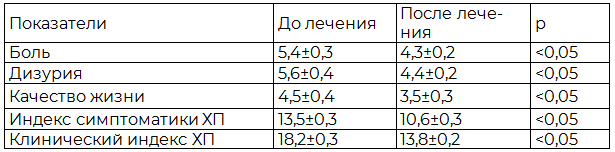
Под влиянием фармако- и пелоидотерапии балльная оценка боли по Международной суммарной оценке симптомов ХП снижается на 20,4%, дизурии – на 21,4%, индекс симптоматики ХП – на 21,5%, клинический индекс ХП – на 24,2%, качество жизни повышается на 22,2% по сравнению с изначальными данными (табл. 2).
Таблица 2. Влияние фармако- и пелоидотерапии на суммарную оценку хронического простатита
Индекс массы тела у больных соответствовал норме (23,6±1,2), что показывало отсутствие метаболических нарушений у обследуемых. После лечения индекс тревоги снизился в 1,6 раза (с 25,4±1,2 до 15,7±1,3, р<0,05), не достигая нормы (11,2±1,4), индекс депрессии – в 1,28 раза (с 9,2±1,3 до 7,2±1,1, р<0,05), не достигая нормы (5,2±1,3).
СФМ повысилась на 16,2% (с 23,5±1,4 до 27,3±1,2, р<0,05), не достигая нормы (31,2±1,3).
Под влиянием фармако- и пелоидотерапии балльная оценка трансректального пальпаторного состояния ПЖ снизилась на 29,5% (с 4,85±1,13 до 3,42±0,23, р<0,05), что имеет высокую корреляцию с данными трансректального УЗИ простаты (r=0,91, р<0,05). Объем ПЖ снизился на 24,7% (с 31,6±2,4 см3 до 23,8±1,3 см3, р<0,05), достигая нормативных данных (19,8±0,2 см3), в результате чего лечения нормальный объем ПЖ наступил у 21 (52,5%) больного.
У больных 1-й группы под влиянием терапии порог болевой чувствительности при нейроальгезиметрии в нейтральных зонах повысился на 11,5% (151,7±11,6 мкА) по сравнению с изначальными данными (134,3±10,2 мкА, р<0,05), в актуальных зонах повысился на 15,4% (146,4±12,5 мкА) по сравнению с изначальными данными (123,9±11,1 мкА, р<0,05).
Допплерометрические исследования показали, что после фармако- и пелоидотерапии в ПЖ наступило повышение Vmax на 11,2%, Vmin – на 56,7%, снижение IR – на 9,2%, IP – на 4,1%, увеличение диаметра сосудов – на 10,4%, ПСС – на 29,6% по сравнению с изначальными данными (табл. 5), в результате чего наступила нормализация гемодинамики ПЖ у 22 (55%) больных.
Таблица 3. Влияние фармако- и пелоидотерапии на гемодинамику предстательной железы у больных хроническим простатитом
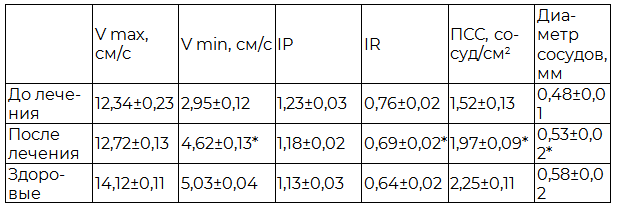
Примечание: * - р<0,05 по сравнению с исходными данными.
ЛДФ-графия в точке проекции ПЖ (табл. 4) показала, что под влиянием фармако- и пелоидотерапии средний поток мочи увеличивается на 36%, коэффициент вариации – на 12,9%, среднее квадратичное отклонение – на 12%, индекс эффективности микроциркуляции – на 27,9%, нейрогенный тонус – на 2,9%, миогенный тонус снизился на 9,5%, показатель шунтирования – на 4% по сравнению с изначальными данными, в результате чего микроциркуляция в ПЖ восстановилась у 19 (47,5%) больных.
Таблица 4. Влияние фармако- и пелоидотерапии на базальный кровоток и микрососудистый тонус в точке проекции предстательной железы у больных хроническим простатитом
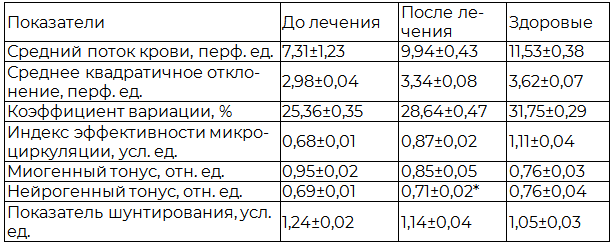
Примечание: * - р<0,05 по сравнению со здоровыми.
Под влиянием фармако-пелоидотерапии активность супреоксиддисмутазы повысилась на 34,6%, глутатионпероксидазы – на 15,3%, глутатионредуктазы – на 32,7%, каталазы – на 25,9%, концентрация ионов цинка – на 21,7% по сравнению с изначальными данными, в результате чего система антиоксидантной защиты нормализовалась у 19 (47,5%) больных.
Таблица 5. Динамика показателей антиоксидантной защиты у больных хроническим простатитом
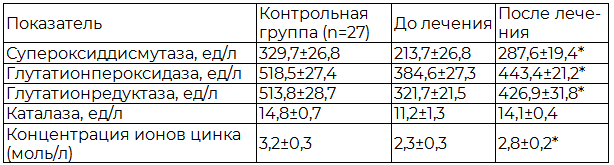
Примечание: * - р<0,05 по сравнению с контролем.
Диаметр парапростатических вен снизился на 26,3% (с 4,2±0,2 мм до 3,1±0,2 мм, p<0,05), не достигая нормативных данных (2,3±0,2 мм), параректальных – на 26,3% (с 4,2±0,3 мм до 3,1±0,2 мм, p<0,05), не достигая нормы (2,3±0,2 мм). Количество больных с расширенными парапростатическими венами снизилось с 34 (85%) до 16 (40%), расширенными параректальными – с 23 (57,5%) до 12 (30%), т.е. нормализация диаметра парапростатических вен наступила у 18 (52,9%), параректальных – у 11 (47,8%) больных.
Скорость венозного кровотока в ПЖ во 2-й группе повысилась на 10,4% (с 4,8±0,2 см/с до 5,3±0,2 см/с, p<0,05), достигая нормативных данных (5,8±0,2 см/с), в результате чего нормализация венозного кровотока в ПЖ наступила у 22 (55%) больных.
Урофлоуметрические исследования во 2-й группе показали, что поcле лечения Qaver повысился на 16,3% (с 11,6±0,2 мл/с до 13,5±0,3 мл/с, p<0,05), не достигая нормы (14,5±0,6 мл/с), Qmax – на 13,4% (c 18,7±1,3 мл/с до 21,2±0,4 мл/с, p<0,05), не достигая нормы (22,1±0,4 мл/с), в результате чего микционная функция мочевого пузыря достигла нормы у 17 (60,7%) из 28 (70%) больных. Корреляционный анализ показал, что по мере снижения объема ПЖ улучшается микционная функция мочевого пузыря (r=0,89, р<0,05), уменьшаются алгический синдром (r=0,87, р<0,05), дискомфорт в промежности (r=0,87, р<0,05), улучшается качество жизни (r=0,93, р<0,05). Остаточная моча в мочевом пузыре снизилась в 1,59 раза (с 15,6±1,3 мл3 до 9,8 мл3, р<0,05). Сила сокращения детрузора повысилась в 1,3 раза (с 18,4±1,3 до 14,1±1,2, р<0,05).
После лечения концентрация ПСА в крови снизилась с 2,68±0,24 нг/мл до 2,33±0,16 нг/мл (p<0,05), не достигая значений нормы (1,87±0,24 нг/мл, р<0,05). После лечения у больных выявлена высокая корреляция между концентрацией ПСА в крови и объемом ПЖ (r=0,87, р<0,05), ПСС (r=0,92, р<0,05), диаметром сосудов в ПЖ (r=0,84, р<0,05), венозным кровотоком в ПЖ (r=0,85, р<0,05).
Непосредственно после лечения у больных в экскримате ПЖ выявлялось повышенное количество лейкоцитов, что показывало улучшение трофической, дренажной и секреторной функций ПЖ. Через 1 мес. после лечения у 35 (87,5%) больных нормализовалось количество лейкоцитов в секрете ПЖ (табл. 6).
Таблица 6. Влияние фармако- и пелоидотерапии на содержание лейкоцитов в секрете предстательной железы у больных хроническим простатитом

Под влиянием фармако- и пелоидотерапии количество лецитиновых зерен в экскримате ПЖ достигло значений нормы у 16 (64%) из 25 (62,5%) больных со сниженным количеством лецитиновых зерен в экскримате ПЖ.
Под влиянием фармако- и пелолидотерапии у больных в периферической крови повышается ИЛ-4 в 1,27, снижается IgG – в 1,09, IgE – в 2, IgM повышается в 1,1, показатель степени напряжения механизмов специфической резистнтности (IgM/IgG) – в 1,25, ЦИК снижаются в 1,2 раза по сравнению с изначальными данными, в секрете ПЖ концентрация ИЛ-4 повышается в 2, sIgA – в 1,4, интерлейкиновый воспалительный индекс снижается в 1,58 раза по сравнению с изначальными данными, в результате чего нормализация гуморального иммунитета наступила у 19 (47,5%), местного – у 23 (57,5%) больных (табл. 7).
Таблица 7. Влияние фармако- и пелоидотерапии на системный и местный иммунитет у больных хроническим простатитом
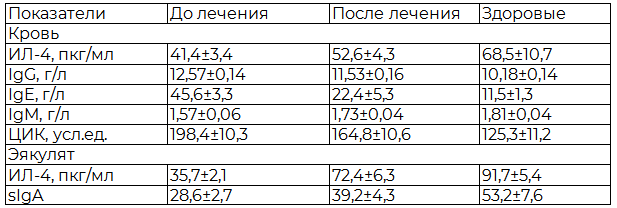
Примечание: * - р<0,05 по сравнению со здоровыми.
В течение 1 года после лечения индекс обострений снизился на 28% (с 2,21±0,14 до 1,59±0,13, р<0,05).
После использования фармако- и пелоидотерапии значительное улучшение наступило у 22 (55%), улучшение – у 11 (27,5%), без улучшения – у 7 (17,5%) больных.
Через 1 год после использования результаты фармако- и пелоидотерапии показали, что значительное улучшение наблюдалось у 18 (45%), улучшение – у 15 (37,5%), без улучшения – у 7 (17,5%) больных.
Таким образом, фармако-пелоидотерапия активно способствует рассасыванию инфильтратов и размягчению склерозированной ткани в ПЖ, улучшает отток секрета и облегчает субъективные расстройства больных.
