Введение. Рак предстательной железы (РПЖ) – является важной социальной проблемой и занимает второе место по заболеваемости онкологическими заболеваниями в мире после рака лёгких и третье место по уровню смертности от рака в развитых странах [1]. Благодаря открытию простатспецифического антигена (ПСА, PSA) и ранней диагностике в последнее десятилетие произошло перераспределение выявляемых стадий в пользу локализованных форм с увеличением количества пациентов, которым показано радикальное лечение. Радикальная простатэктомия (РПЭ) – наиболее часто используемый метод лечения РПЖ. Полное хирургическое удаление – это оптимальный метод лечения РПЖ у правильно отобранных пациентов [2]. Несмотря на совершенствование техники РПЭ, применение лапароскопических и робот-ассистированных вмешательств число осложнений данной операции остаётся на высоком уровне [3]. Наиболее частые осложнения позднего послеоперационного периода: эректильная дисфункция (ЭД), недержание мочи (НМ), тотальное или частичное, стриктуры везикоуретрального анастомоза (ВУА) [4]. Послеоперационное недержание – основной барьер для достижения уровня качества жизни (КЖ), которое было у пациентов до РПЭ [5]. Публикуемые данные по степени недержания и количеству пациентов, страдающих инконтиненцией, сильно варьируют [6]. О «значимом» или «надоедливом» НМ сообщают от 2 до 44,5% мужчин, однако если говорить о любой неконтролируемой потере мочи этот процент становится значительно выше [7, 8].
После РПЭ возможно возникновение различных форм МН: стрессового – за счёт сфинктерной недостаточности; ургентного – за счёт гиперактивности детрузора; недержания при переполнении за счёт формирования стриктур ВУА; смешанных форм НМ. Ficazzola & Nitti (1998) обнаружили, что из 46% пациентов имеющих дисфункцию мочевого пузыря, недержание при уродинамическом исследовании определялось лишь в 27% случаев – у подавляющего большинства причина недержания кроется в сфинктерной дисфункции [9]. Groutz et al. (2000) обнаружили пузырную дисфункцию у 33% пациентов, но доказали, что главной причиной недержания она является у 7,25% [10].
Согласно Рекомендациям Европейского Общества Урологов от 2013 г. у пациентов с НМ после РПЭ первостепенно применяются консервативные методы лечения [11]. Эффективность консервативной терапии, направленной на укрепление мышц тазового дна, доказана у женщин, что подтверждается многочисленными исследованиями и систематическими обзорами литературы [12]. Что же касается НМ у мужчин – сделать однозначные выводы намного сложнее [13].
Цель исследования. Обоснование применения консервативной терапии у пациентов с НМ после РПЭ для улучшения их качества жизни.
Материалы и методы. В исследовательскую работу были включены 64 пациента с локализованными формами РПЖ T2a – T2c и НМ, наблюдаемые в отделении оперативной урологии РНЦРХТ с 2011 г. после РПЭ, выполненной, как в урологическом отделении Центра, так и в других клиниках. В табл. 1 представлены критерии включения и исключения пациентов для участия в исследовании.
Таблица 1. Критерии включения и исключения пациентов для участия в исследовании
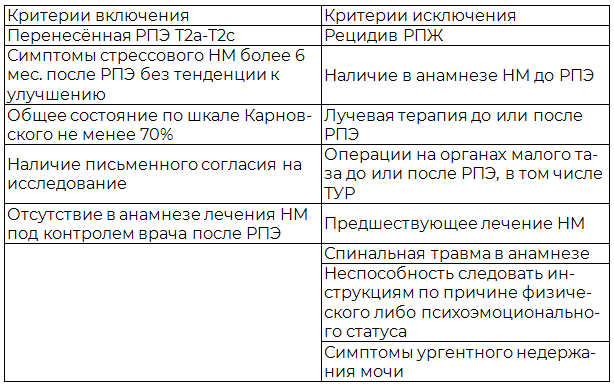
Методика обследования пациентов была основана на Клинических рекомендациях Европейского общества урологов и включала:
1. Сбор анамнеза заболевания.
2. Объективное обследование.
3. Неврологическое обследование.
4. Выполнение кашлевой пробы и пробы Вальсальвы.
5. Заполнение пациентами трёхдневного дневника мочеиспусканий.
6. Общий и микробиологический анализ мочи с антибиотикограммой.
7. Ультразвуковое исследование (УЗИ) мочевого пузыря с определением объёма остаточной мочи.
8. Урофлоуметрию.
9. При подозрении на наличие стриктуры ВУА – микционную уретроцистографию, уретроцистоскопию
10. Определение уровня PSAобщ. для исключения рецидива заболевания.
Для оценки степени влияния недержания на КЖ, а так же степени и типа инконтиненции использовался опросник по влиянию НМ на КЖ ICIQ-SF (International Consultation on Incontinence Questionnaire Urinary Incontinence Short Form), являющийся специфическим опросником для данной патологии и имеющий высокий уровень надёжности – коэффициент - Кронбаха – 0,92 [14].
В связи с наличием инфравезикальной обструкции за счёт стриктуры ВУА - 9 человек были исключены из дальнейшего исследования и в плановом порядке госпитализировались на урологическое отделение ФГбУ РНЦРХТ для лечения данной патологии.
Ещё 8 пациентов были исключены из исследования в связи с наличием у них симптомов ургентного и смешанного НМ. Пациенты с данной патологией получали рекомендации по тренировке мочевого пузыря, терапию М-холиноблокаторами и рекомендации по укреплению мышц тазового дна. Анализ данной группы не выполнялся в связи с невозможностью однозначной интерпретации результатов лечения. Оставшиеся пациенты (n=47) были разделены на две сопоставимые группы: «Тренировка мышц тазового дна (ТМТД)» - (n=23); «Амплипульстерапия» - (n=24).
В табл. 2 представлены основные характеристики исследовательских групп до лечения.
Таблица 2. Характеристика исследовательских групп до начала лечения
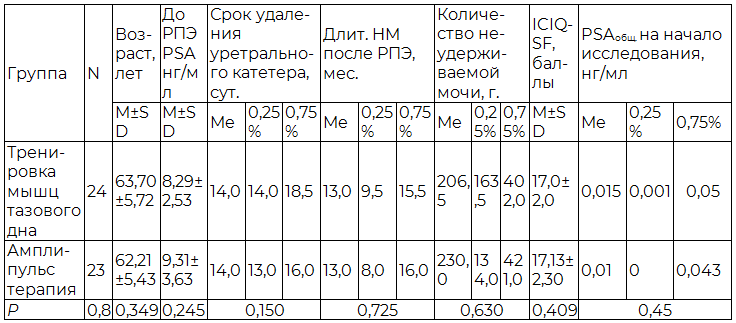
Пациенты группы «ТМТД» обучались методике укрепления мышц тазовой диафрагмы, основанной на упражнениях А. Кегеля, в режимах медленных и быстрых сокращений. Обучение включало обоснование необходимости выполнения упражнений, описание анатомии мышц тазового дна, устные рекомендации по идентификации целевых мышц, непосредственное объяснение методики правильных сокращений, а так же контроль за правильностью выполнения упражнений посредством пальцевого ректального исследования во время первичной беседы и далее один раз в месяц в течение всего курса терапии. Помимо выполнения упражнений, пациентам рекомендовалось сокращать мышцы тазовой диафрагмы при каждой ситуации, способной спровоцировать подтекание мочи для формирования условного рефлекса на сокращение, а так же следование рекомендациям по изменению образа жизни на период лечения – исключение из рациона кофеинсодержащих продуктов и напитков, алкоголя, коррекция веса, отказ от курения и т.д.
Пациенты группы «Амплипульстерапия» получали лечение синусоидальными модулированными токами малой силы с использованием аппарата «Амплипульс - 7» ОАО «Завод «Измеритель». Использовались поверхностные электроды: первый (катод, 4х3см) – по длиннику промежности, второй (анод, 8х4см) – над лонным сочленением. После установки электроды подключались в одноканальном двухполярном режиме. Устанавливались параметры, позволяющие проводить сеансы прерывистыми сериями модулированных колебаний на частоте 50Гц первую неделю с коэффициентом модуляции 75% с длительностью посылки 2с., длительностью паузы – 3с. в течение 10 мин., начиная со второй недели с коэффициентом модуляции 100% с длительностью посылки 4с., длительностью паузы – 6с. в течение 15 мин. Сеансы проводились три раза в неделю в течение 4 - 12 недель. Помимо амплипульстерапии пациенты получали рекомендации по изменению образа жизни и сокращениям мышц тазового дна в провоцирующих ситуациях, аналогичные рекомендациям для группы «ТМТД».
В обеих группах до лечения, а так же на фоне проводимого лечения на 1, 3, 6 и 12 мес. оценивалось количество неудерживаемой мочи и проводилось анкетирование по опроснику ICIQ-SF для оценки влияния НМ на КЖ. Определение уровня PSAобщ. проводилось до лечения, а так же через 6 и 12 мес. от начала исследования.
Статистическая обработка получаемых данных осуществлялась с помощью компьютерных программ Microsoft Excel (Microsoft Office 2007, USA) с надстройкой AtteStat 12.0.5, STATISTICA 6.0 (Statsoft, 2006, USA). Различия считались достоверными при р <0,05. При соответствии критериев нормальности нормальному распределению достоверность различий оценивалась с использованием T-критерия Стьюдента. При несоответствии – методы непараметрической статистики (U – критерий Манна – Уитни; критерий Вилкоксона). Для оценки меры линейной связи между случайными величинами использовалась ранговая корреляция Спирмена.
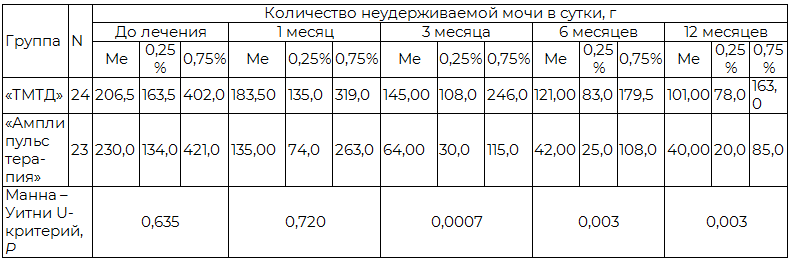
Результаты. Исследование эффективности ТМТД показало наличие достоверной положительной динамики снижения количества неудерживаемой мочи в группе «ТМТД» (n=24) по сравнению с исходными показателями. До начала лечения количество неудерживаемой мочи в среднем составило 308,45г. (Me=206,5). Через 1 мес. терапии количество теряемой мочи уменьшилось на 14,77% (p <0,0001) и составило в среднем 262,87г. (Me=183,5). Через 3 мес. количество сократилось на 32,91% от исходного и составило в среднем 206,91г. (Me=145,0), улучшение по сравнению с показателем на отметке 1 мес. составило 21,28% (p <0,0001). Через 3 мес. ТМТД один пациент (4,1%) отметил полное отсутствие подтекания мочи. Обследование пациентов группы через 6 мес. показало снижение неудерживаемого количества на 50,12%, в среднем до 153,83г. (Me=121,0) и улучшение показателя предыдущего контроля на 25,65% (p <0,0001). Оценка динамики удержания мочи через 12 мес. показала снижение среднего количества неудерживаемой мочи в группе на 55,26% до 138г. (Me=101,0). Динамика снижения потерь мочи между контрольными точками 6 и 12 мес. составила 10,29%, тем не менее, эти изменения оказались статистически не значимы (p <0,08). Рис. 1 иллюстрирует динамику снижения количества неудерживаемой мочи в группе «ТМТД» на фоне лечения.
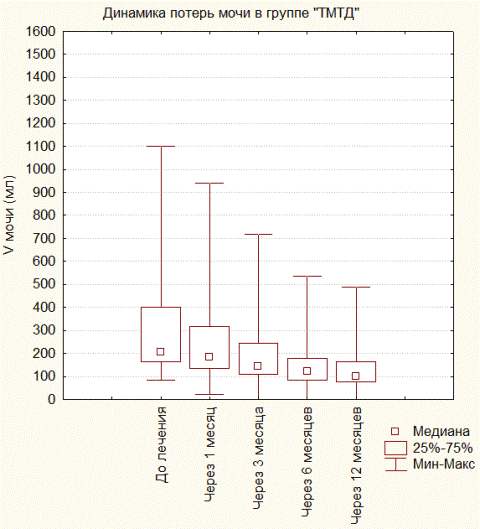
Рис. 1. Количество неудерживаемой мочи в группе ТМТД.
Анализ результатов лечения в группе «Амплипульстерапия» (n=23) показал наличие достоверных различий в количестве неудерживаемой мочи через 1 мес. терапии по сравнению с исходными показателями, снижение на 43,29% (p<0,0006). Средняя потеря мочи до лечения - 305,17 г. (Me=230,0), через 1 мес. – 173,04 г. (Me=173,04). Через 3 мес. амплипульстерапии среднее количество неудерживаемой мочи сократилось на 71,42% и составило 87,21г. (Me=64,0), а улучшение по сравнению с контролем через 1 мес. составило 49,6% (p<0,0001). Через 6 мес. количество неудерживаемой мочи сократилось на 75,56% от исходного, средний объём 74,56 г. (Me=42,0). Измерение количества неудерживаемой мочи через 6 мес. не выявило различий в динамике по сравнению с контрольной точкой 3 мес., количество неудерживаемой мочи снизилось на 14,5% (p<0,115). Через 12 мес. отмечено снижение количества неудерживаемой мочи на 78,1% по сравнению с измерениями до лечения, среднее количество неудерживаемой мочи в группе – 66,78 г. (Me=40,0). Достоверные различия между измерениями 6 и 12 мес. отсутствовали (p<0,6). Рис. 2 иллюстрирует динамику снижения количества неудерживаемой мочи в группе «Амплипульстерапия» на фоне лечения.
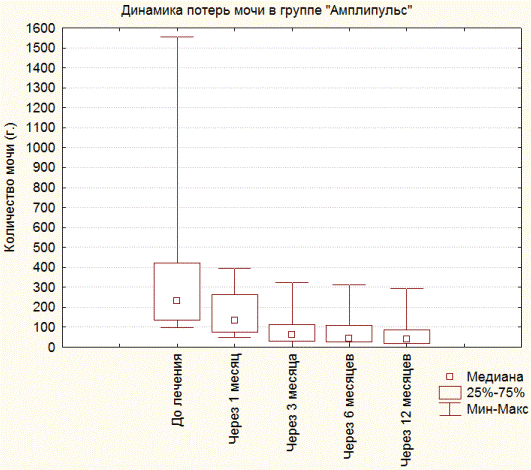
Рис. 2. Количество неудерживаемой мочи в группе «Амплипульстерапия».
Сравнительный анализ динамики снижения количества неудерживаемой мочи в исследовательских группах показал отсутствие различий через 1 мес. и наличие достоверных различий на 3, 6 и 12 мес. наблюдения. Проведение сеансов амплипульстерапии позволило достигнуть более значимого снижения суточного количества неудерживаемой мочи по сравнению с пациентами, которым проводилась консервативная терапия в объёме ТМТД. В табл. 3 представлены результаты сравнительного анализа эффективности ТМТД и амплипульстерапии.
Таблица 3. Анализ эффективности ТМТД и амплипульстерапии
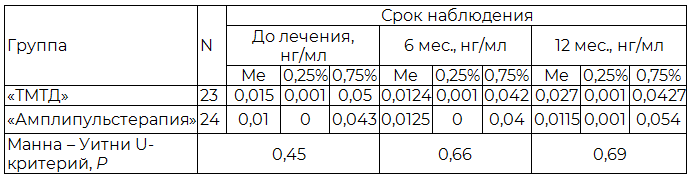
Анализ влияния применяемых методов лечения на изменение значений уровня PSAобщ. не выявил статистически значимых изменений уровня PSAобщ., как внутри групп в динамике, так и между группами (p>0,05). Уровень статистически значимых различий PSAобщ. между группами консервативной терапии до лечения, через 6 и 12 месяцев терапии отображён в табл. 4.
Таблица 4. Динамика PSAобщ. в группах на фоне лечения
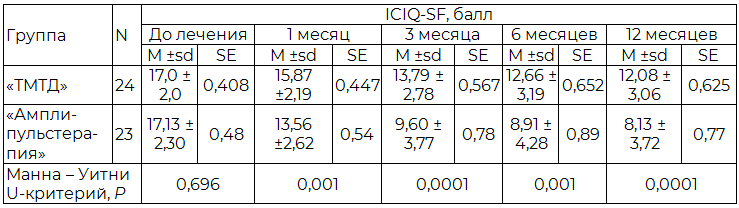
Анализ влияния НМ на КЖ выявил резкое снижение КЖ, в обеих исследовательских группах до начала лечения. Согласно полученным данным в группе «ТМТД» значимое улучшение КЖ на фоне лечения отмечено вплоть до 6 мес. наблюдения (p<0,001). Анализ опросников ICIQ-SF группы «Амплипульстерапия» продемонстрировал значимое улучшение КЖ пациентов через 1 и 3 мес. терапии по сравнению с показателями до лечения. Несмотря на тенденцию к снижению количества баллов, набранных по опроснику через 6 мес. наблюдения, по сравнению с контрольной точкой «3 месяца» достоверные различия отсутствовали. Через 12 мес. наблюдения КЖ пациентов соответствовало уровню, измеренному на контрольной точке 3 мес., значимого улучшения или снижения не выявлено. В табл. 5 представлен сравнительный анализ КЖ пациентов в исследовательских группах на фоне лечения.
Таблица 5. Качество жизни, оцененное по опроснику ICIQ-SF, в исследовательских группах
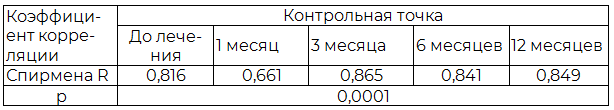
Анализ взаимосвязи количества неудерживаемой мочи по данным дневников мочеиспускания со значениями КЖ, оцененного по опроснику ICIQ-SF, выявил наличие сильной положительной корреляции до лечения, а так же на 3, 6 и 12 мес. терапии. Через 1 мес. терапии выявлена умеренная положительная корреляция между исследуемыми факторами. Результаты анализа представлены в табл. 6.
Таблица 6. Зависимость количества неудерживаемой мочи и показателей КЖ
Обсуждение. Наиболее близким по дизайну и полученным результатам к данной работе является исследование Goode P.S. et al. (2011), в котором проводился анализ эффективности методов консервативной терапии у мужчин, страдающих НМ более года после РПЭ [15]. К 8 неделе терапии 15,7% пациентов группы поведенческой терапии и 17,1% пациентов группы «Биологическая обратная связь + Электростимуляция» достигли полного удержания по данным 7-дневных дневников мочеиспускания. Тем не менее, в исследовательские группы были включены, как пациенты со стрессовым, так и пациенты с ургентным и смешанным НМ, что не позволяет провести более прецизионное сравнение результатов. Несмотря на периодически возникающие споры об эффективности ТМТД в лечении НМ после РПЭ, большинство исследователей сходятся в едином мнении – ТМТД – основа консервативной терапии [16]. В литературе описаны более 10 различных методик по укреплению мышц тазового дна, основанные на упражнениях А. Кегеля, тем не менее, оптимальный протокол не найден, а сравнение эффективности различных методов не проводилось [17]. В данной работе обучение ТМТД в режимах быстрых и медленных сокращений способствовала восстановлению функции удержания мочи. Наибольший эффект от лечения наблюдался в интервале от 3 до 6 мес., проведение терапии более 6 мес. позволило сохранить достигнутый лечебный эффект, но в динамике не привело к его улучшениям. Результатом терапии стало снижение количества неудерживаемой мочи через 3 мес. на 23,91%, а к 12 мес. на 52,26%, полное отсутствие НМ было отмечено лишь одного пациента (4,1%). Полученные данные не столь оптимистичны, в отличие от результатов Parekh et al. (2003), когда к 52 неделе ТМТД 82% пациентов достигли континентного статуса [16]. Впрочем, этот диссонанс может быть связан с разницей в сроках начала проведения лечения НМ в исследованиях, так как в данной работе в исследование включены пациенты с НМ более 6 мес. после РПЭ и не получавшие до этого лечения.
Результаты, полученные в нашем исследовании, доказали высокую эффективность электростимуляции посредством амплипульстерапии в лечении НМ после РПЭ. Заполнение дневников мочеиспускания через 12 мес. после начала исследования показало снижение количества неудерживаемой мочи в группе амплипульстерапии на 78,1% по сравнению со значениями до лечения. Полученные результаты сопоставимы с исследованием Yamanishi et al. (2010), когда к 12 мес. терапии мочу удерживали 86% группы [18]. Результаты оценки скорости восстановления функции удержания при проведении ЭС также сопоставимы с результатами публикаций научной периодики: в данной работе максимальный эффект восстановления удержания наблюдался к третьему месяцу лечения с последующим формированием «плато восстановления», в работе Yamanishi et al. максимальный эффект был достигнут к сроку 2,71 ±2,6 мес., в исследовании Mariotti et al. максимальное восстановление функции удержания наблюдалось на 2 мес. ЭС [18, 19].
В большинстве исследований, посвящённых консервативной терапии НМ после РПЭ, сделаны выводы что, несмотря на более быстрое восстановление удержания, ЭС тазового дна не улучшает результатов ТМТД [20]. В данной работе проведение сеансов амплипульстерапии позволило достигнуть достоверного (p <0,05) снижения суточного количества неудерживаемой мочи у пациентов, страдающих стрессовой инконтиненцией после РПЭ по сравнению с пациентами, которым проводилась консервативная терапия в объёме ТМТД. Вероятнее всего, это связано с прямым нейромиостимулирующим эффектом синусоидальных модулированных токов на мышцы тазового дна, активацией микроциркуляторного русла ишемизированных тканей, а так же стимуляцией репаративной регенерации тканей уретрального сфинктера [21].
Анализ влияния консервативной терапии на КЖ, обусловленного НМ, показал, что оба исследуемых метода лечения значимо улучшают КЖ пациентов. Применение амплипульстерапии позволило достигнуть более высокого КЖ за меньший промежуток времени. Полученные результаты подтверждают наличие сильной положительной корреляции между количеством неудерживаемой мочи и балльной оценкой опросника ICIQ-SF (r > 0,7), имеющийся в литературе [22]. Наличие столь значимой зависимости позволяет предположить целесообразность применения опросника ICIQ-SF в качестве скринингового инструмента для оценки эффективности терапии НМ на разных сроках лечения без дополнительного применения прокладочного теста.
Традиционно считалось, что при онкологических заболеваниях абсолютно противопоказано применение физических факторов: онкология и физиотерапия всегда были несовместимыми областями медицины [23]. При проведении литературного поиска не было найдено исследований, доказывающих отрицательное влияние электростимуляции на риск развития рецидива РПЖ после РПЭ. В данной работе выполнена оценка динамики PSAобщ., в разные сроки проведения консервативной терапии. Проведённый анализ не выявил достоверных изменений уровня PSAобщ., как внутри групп в динамике (p > 0,05), так и между группами (p > 0,05), что свидетельствует об отсутствии влияния ТМТД и амплипульстерапии на повышение уровня PSAобщ.. Результаты указывает на безопасность применения исследуемых методов и подтверждают постулат, что физиотерапия не противопоказана больным после радикальных операций по поводу удаления злокачественных опухолей, у которых физические факторы применяют в программах комплексного послеоперационного восстановительного лечения [24].
Заключение. Проведение сеансов амплипульстерапии позволяет достигнуть более значимого снижения количества неудерживаемой мочи у пациентов, страдающих стрессовым НМ после РПЭ по сравнению с пациентами, которым проводилась консервативная терапия в объёме ТМТД. Оба метода консервативной терапии значимо улучшают КЖ пациентов. Применение амплипульстерапии позволяет достигнуть более высокого КЖ за меньший промежуток времени. ТМТД и амплипульстерапия не влияют на динамику PSAобщ. и не увеличивают риск возникновения рецидива РПЖ у пациентов после РПЭ. Опросник ICIQ-SF – эффективный инструмент скрининговой оценки не только КЖ, но и количества неудерживаемой мочи. Получено решение на выдачу патента на изобретение «Способ лечения недержания мочи после радикальной простатэктомии» №2013133338.
