Введение. В 2012 г. злокачественными новообразованиями мочевых и мужских половых органов в России заболели 64,9 тыс. человек.
Рак мочевого пузыря (РМП) составляет по данным ВОЗ около 4% от всех злокачественных новообразований или 70% всех опухолей мочевого тракта. В России на долю РМП в структуре онкологической заболеваемости приходится 2,7%. [1]. Комплексный анализ её динамики за 2002-2012 г. в России показал увеличение заболеваемости с 8,49 до 9,93 на 100 тысяч населения, общий прирост составил 16% [2].
По данным многих зарубежных клинических исследований наиболее распространённую клиническую форму заболевания (около 70%) составляет группа так называемого поверхностного рака мочевого пузыря [3].
Применительно к современной Международной классификации (2004) это стадии CIS, Ta, T1, т.е. опухоли, ограничивающиеся слизистым и подслизистым слоями [4].
Около 70% поверхностного рака после трансуретральной резекции рецидивируют на протяжении 5 лет, достигая 90% в течение 15 лет. Важным является тот факт, что около 20% поверхностных форм перерождаются в мышечно-инвазивный рак [5,6].
В связи с этим, было предложено деление поверхностных переходно-клеточных карцином на группы по риску рецидивирования и прогрессирования.
К первой группе относятся опухоли с низким риском рецидивирования, единичные, в стадии TaG1, менее 3 см в диаметре. Ко второй группе необходимо отнести опухоли с высоким риском рецидивирования – в стадии T1G3, мультифокальные или часто рецидивирующие, имеющие сопутствующую карциному in situ (CIS) уротелия. Третью группу составляют опухоли с промежуточным риском: Ta, Т1, G1-2, мультифокальные, более 3 см в диаметре [7-9].
Под прогрессированием поверхностного рака мочевого пузыря понимают развитие инвазивного рецидива опухоли (критерий Т), возрастание степени клеточной анаплазии (критерий G) или наличие метастатического процесса (критерий М) [10].
Т.к. группировка больных по морфологическим характеристикам отражает биологический потенциал уротелиальной карциномы, всегда большое значение приобретает поиск маркеров диагностики и прогноза у пациентов с поверхностным раком мочевого пузыря.
Необходимо выявление группы пациентов с низкой вероятностью прогрессирования, для исключения более травматичных видов лечения (цистэктомии), снизить показатель смертности.
При лечении поверхностного (РМП) основными факторами, определяющими частоту рецидивов и прогрессии, являются стадия Т (Та, Т1, Тis) и степень дифференцировки опухоли (G) [11-17].
Необходимость замедлить или предотвратить переход поверхностного РМП в инвазивный обусловлена тем, что инвазия значительно ухудшает прогноз, выживаемость, качество жизни и принципиально меняет тактику лечения [18].
Хирургическое лечение поверхностного рака мочевого пузыря. В настоящее время хирургические методы являются ведущими в лечении рака мочевого пузыря.
В большинстве стран мира в последние годы у больных раком мочевого пузыря выполняют только два вида оперативных вмешательств: ТУР и цистэктомию.
Трансуретральная резекция. Трансуретральная резекция (ТУР) мочевого пузыря в стадиях Та, Тis, Т1 вместе с опухолью является «золотым стандартом» [29].
ТУР является лечебно-диагностической операцией. Главная цель операции - радикально удалить опухоль. Мелкие или имеющие узкое основание опухоли можно удалить одним срезом петли. Основание опухоли резецируется с мышечным слоем и отправляется на гистологическое исследование раздельно. В конце операции проводится тщательный гемостаз. Крупные поверхностные опухоли не удаётся резецировать одним движением петли резектоскопа. Необходимо последовательно удалять первоначально экзофитный компонент, а затем ножку и основание опухоли.
Гистолог получает и проводит исследование очень большого количества (до 100 и более) кусочков удалённой ткани и не всегда качественных, а хирургу приходится маркировать удаляемый послойно материал.
Материалы и методы. С 2003 по 2012 г. в ГАУЗ РКОД МЗ РТ по поводу впервые выявленного поверхностного рака мочевого пузыря трансуретральная резекция (ТУР) мочевого пузыря проведена 546 пациентов. В исследование были включены 270 пациентов.
Критериями включения были:
Гистологический тип опухоли - переходноклеточный РМП.
Стадия заболевания Ta, T1, Tis.
Срок наблюдения более 12 месяцев.
Для анализа результатов пациенты были разделены на две группы основную и контрольную. В основную группу вошли пациенты с поверхностным раком мочевого пузыря, а также пациенты, подвергнутые ТУРу со стенками мочевого пузыря с опухолью единым блоком. В контрольную группу отобраны больные поверхностным раком мочевого пузыря, которым выполнена стандартная ТУР.
Общая характеристика представлена в табл. 1.
Таблица 1. Общая характеристика пациентов

Пациентам выполнялось полное клиническое, лабораторное и инструментальное обследование.
Характеристика методов диагностики и лечения. Пациентам была выполнена флуоресцентная ТУР мочевого пузыря по двум методикам.
Операцию начинали с флуоресцентной цистоскопии с помощью резектоскопа. Использовали раствор фотосенсибилизатора - 5-аминолевулинновой кислоты (5-ALA), разведённой в 40 мл 4% гидрокарбоната натрия, введённого внутрипузырно за два часа до операции.
Для минимизации эффекта фотообесцвечивания было выполнено следущее:
1. Операцию начинали с обзорной цистоскопии в белом свете по стандартной методике, при этом применяли минимальное освещение органа.
2. В полости мочевого пузыря для обеспечения оптимальной видимости использовали резектоскоп типа Iglesias с промывной системой с постоянной ирригацией и вакуум аспирацией промывной жидкости. Остановки кровотечения добивались электрокоагуляцией кровоточащих участков опухоли.
3. После визуализации видимых в белом свете опухолей переходили на флуоресцентную диагностику. При этом вели видеозапись. Вокруг флуоресцирующих участков, подозрительных на опухолевое поражение слизистой, с помощью петли резектоскопа производили обозначение границ резекции. Если же по какой-то причине произошла задержка в начале резекции и наступило затухание флуоресценции (эффект фотообесцвечивания), то проведённая в начале видеозапись помогала уточнить границы и место флуоресценции.
Остальные условия флуоресцентной диагностики РМП проводились по общепринятым методикам.
В контрольную группу вошли пациенты, получившие стандартную ТУР. После осмотра уретры и мочевого пузыря последовательно производили электрорезекцию всех подозрительных участков слизистой, светившихся красным светом при исследовании мочевого пузыря в фиолетовом свете. Далее операцию выполняли по общепринятой методике.
В основную группу вошли пациенты, которым выполнялась ТУР стенки мочевого пузыря с опухолью единым блоком. После осмотра уретры и мочевого пузыря последовательно производили электрорезекцию всех подозрительных участков слизистой светившихся красным светом при исследовании мочевого пузыря в фиолетовом свете. Далее операцию выполняли по модифицированному способу - электрорезекцию с коагуляцией кровеносных сосудов стенки мочевого пузыря, основания и саму опухоль до 2-3 см осуществляют единым блоком (совместно), ретроградными движениями электрода-петли, поддерживая резецируемую ткань концом электрода-петли. Захватывалась вся толщина стенки мочевого пузыря до паравезикальной клетчатки, проводилась электрорезекция макроскопически неизменённой слизистой вокруг опухоли с целью исследования линии резекции, с последующей эвакуацией фрагментов через просвет тубуса резектоскопа или по уретре, прижимая препарат петлёй к краю тубуса резектоскопа. При большом размере опухоли мочевого пузыря, более 2-3 см, предварительно её не полностью резецируют с коагуляцией кровоточащих сосудов стенки мочевого пузыря с основанием опухоли и экзофитной части опухоли. Затем резецируют экзофитную часть опухоли до основания и окончательно резецируют стенку мочевого пузыря с основанием опухоли единым блоком с последующим захватом жёсткими щипцами материала и эвакуацией по уретре вместе с тубусом резектоскопа.
Это обеспечивает минимальное электрохирургическое воздействие на ткани стенки мочевого пузыря и позволяет предоставить целостный и качественный материал для гистологического исследования. При этом способе операции обеспечивается лёгкий и надёжный гемостаз благодаря быстрому доступу сразу к главным сосудам, питающим опухоль, и удалению её единым блоком. Мы полагаем, что электрорезекция опухоли мелкими частями приводит к термическому повреждению ткани, что может приводить к ошибкам в стадировании глубины инвазии опухоли в стенку мочевого пузыря после проводимой стандартным способом ТУР мочевого пузыря, может способствовать рецидиву возникновения опухоли, как в области операции, так и на других стенках мочевого пузыря, вследствие фрагментации опухоли.
Нами был предложен и изготовлен инструмент для осуществления предлагаемого способа ТУР опухоли мочевого пузыря, суть которого в том, что ветви проводников электрода-петли образуют единое травмобезопасное целое с рамочным концом из пружинного материала изменяемого размера и большего, чем проходное сечение тубуса резектоскопа. Это обеспечивает поддержку резецируемой ткани и визуальное наблюдение за положением электрода-петли при её ретроградном движении в оперируемой ткани.
Резецированный материал в виде экзофитной части опухоли с подлежащей стенкой мочевого пузыря единым блоком, либо экзофитной части опухоли в виде мелких кусочков шириной около 5 мм и длиной до 2 см и основания опухоли с подлежащей стенкой мочевого пузыря единым блоком в разных промаркированных пробирках доставлялся в патологоанатомическое отделение.
Получение качественного, целостного материала, а так же совместная работа клинициста и патологов позволила в гистологическом заключении добавить ещё один критерий оценки опухоли - глубина инвазии в собственную мышечную пластинку слизистой.
Результаты лечения больных с проведённой ТУР стенки мочевого пузыря с опухолью единым блоком.
Средняя продолжительность операции - 31 минута.
Во время операции осложнений не отмечено.
Поздние осложнения – стриктура устья резецированного мочеточника возникла у 9 (9,6%) больных. Итраоперационная летальность – 0.
В 32 случаях (34%) при наблюдении выявлен рецидив рака.
Результаты операций стандартная ТУР и ТУР стенки мочевого пузыря с опухолью единым блоком представлены в табл. 2.
Таблица 2. Результаты операций стандартная ТУР и ТУР стенки мочевого пузыря с опухолью единым блоком
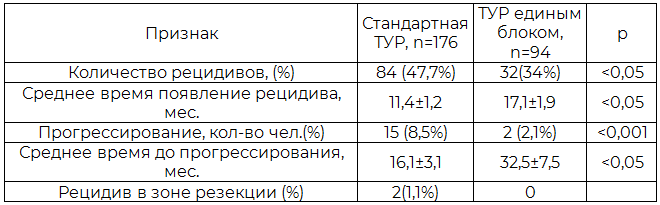
Из табл. 2 видно, что методика операции влияет на частоту, снижая с 47,7% при стандартной ТУР до 34% при ТУР единым блоком, и незначительно на сроки до появления рецидивов (p<0,05).
У 15 (8,5%) из 176 больных, подвергнутых стандартной ТУР, отмечено прогрессирование заболевания, в среднем, через 16,1±3,1 (от 2 до 40) месяца после операции. Прогрессирование заболевания зафиксировано у 2 (2,1%) из 94 больных, подвергнутых ТУР единым блоком, в среднем, через 32,5±7,5 (от 6 до 9) месяца после операции. Применение ТУР единым блоком снижает частоту прогрессирования в 4 раза (p<0,001) и увеличивает сроки до прогрессирования почти в 2 раза (p<0,05), позволяет свести рецидивы в зоне резекции до минимальных значений и увеличить время до возникновения рецидива.
Различий частоты рецидивирования в зависимости от возраста не выявлено. Рецидив отмечен у 21,9% пациентов моложе и у 28,6% больных старше 60 лет. Частота появления рецидива при поражении дна мочевого пузыря, передней стенки, задней стенки, боковой стенки, треугольника Льетто и шейки мочевого пузыря составила 42,9, 45,0, 29,7, 22,0, 28,9 и 30,0% соответственно, в то время как в целом было выявлено 27,0% пациентов с рецидивами.
Отмечена тенденция к увеличению частоты рецидивирования у пациентов с множественными опухолевыми образованиями (42,5%) по сравнению с группой больных, у которых имелись одиночные опухоли (21,3%) (р=0,001).
Размеры новообразования мочевого пузыря оказывали влияние на частоту рецидивов. Рецидивы зарегистрированы у 19,5% пациентов с опухолями менее 3 см в d и у 34,3% больных, у которых опухолевое образование имело диаметр более 3 см (р=0,009).
Влияния гистопатологической дифференцировки опухоли на риск рецидивирования не выявлено. При G=1 выявлено 26,3% рецидивов, при G=2 – 22,9%, при G=3 зафиксировано 32,9% рецидивов.
Умерли всего 25 чел. (9,3%). От причин, связанных с основным заболеванием, умерли 9 чел. (3,3%), из них при ТУР стандартная – 7 (4,0%) чел., ТУР единым блоком – 2 (2,1%) чел.
Статистически достоверных отличий в показателях выживаемости, связанных с основным заболеванием, в зависимости от вида операции не выявлено (р = 0,465). Медиана выживаемости не достигнута ни при одном из видов операции.
Выводы. Вид операции не влияет на специфическую выживаемость, ТУР блоком снижает частоту рецидивов, время до появления рецидива, частоту прогрессирования, время до его наступления.
ТУР блоком позволяет точно поставить диагноз по категории Т, а значит правильно выбрать тактику лечения и снижает рецидивы в рубце до 0%.
